El exoma y su papel en el diagnóstico de errores congénitos del metabolismo
El exoma es la parte del genoma (conjunto de moléculas de DNA) formado por los exones, los fragmentos de DNA que se transcriben para dar lugar a las proteínas. El estudio del exoma es una de las formas más completas y complejas de estudiar nuestro DNA.
Antes de explicar qué es el exoma, repasaremos algunos conceptos necesarios.
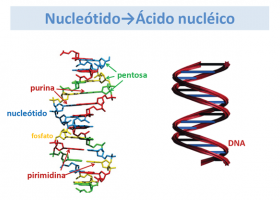
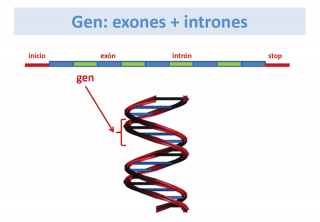
Un gen es la unidad de material genético que aporta la información necesaria para la síntesis de una proteína. Un gen está formado por una larga cadena de nucleótidos, en la que se distinguen exones e intrones.
Los exones son las regiones codificantes que van a proporcionar la información para la síntesis de una proteína, mientras que los intrones son regiones no codificantes, que se hallan intercaladas en el gen y tienen otras funciones.
El exoma humano consiste en, aproximadamente, 180.000 exones que constituyen cerca del 1% del total del genoma (unas 30 megabases de DNA).
El estudio del exoma puede ser necesario para llegar a un diagnóstico genético
El diagnostico genético es una herramienta médica que permite determinar las causas genéticas de una enfermedad.
Las enfermedades tienen unas características clínicas que las determinan como tal, diferenciándolas de otra enfermedad. Muchas enfermedades tienen base genética, es decir, la enfermedad se debe a mutaciones en un gen determinado.
Un diagnóstico genético consiste en detectar el gen y las mutaciones en el mismo que causan la enfermedad.
¿Qué es una mutación?
Una mutación es un cambio de pares de bases en la secuencia del DNA con respecto a la secuencia original.
Todos heredamos 23 cromosomas de cada uno de nuestros padres que contienen largas moléculas de DNA. Las mutaciones ocurren en todos nosotros. Se trata de pequeños cambios, donde uno o dos pares de bases no se alinean correctamente durante la fase temprana de la división celular, que ayudan a hacer que cada uno de nosotros seamos únicos.
La mayoría de los cambios genéticos se sitúan en regiones del DNA que no implican un impacto biológico, es decir, no alteran la función normal de nuestro organismo. Pero a veces la mutación se produce en un gen funcional y provoca problemas. Estos problemas son los que causan enfermedades de base genética.
La secuenciación de nueva generación permite conocer todos los genes codificadores
Con este nombre (en inglés New Generation Sequencing) habitualmente se hace referencia a las nuevas técnicas de secuenciación masiva que permiten conocer la información que se encuentra en nuestro genoma (todo nuestro DNA), de forma rápida y cada vez más económica.
Secuenciación del exoma es una técnica para secuenciar (conocer la secuencia de las bases de DNA, es decir, cómo se ordenan en la cadena de DNA) todos los genes codificadores.
Consiste en seleccionar primero ese subconjunto de DNA que codifica las proteínas, es decir, los exones. En un paso posterior se trata de identificar la secuencia usando una tecnología de secuenciación de DNA de alto rendimiento o secuenciación masiva.
Las técnicas de secuenciación masiva han experimentado en los últimos años grandes avances. El primero de ellos, y fundamental para la interpretación de los resultados de estos estudios, fue la finalización del Proyecto Genoma Humano (PGH) en el año 2003.
Fue un proyecto internacional que comenzó en el año 1990 con el objetivo de determinar la secuencia de pares de bases químicas que componen el DNA humano, y de identificar y mapear todos los genes del genoma humano, tanto desde el punto de vista físico como funcional. Ha sido el proyecto biológico de colaboración internacional más grande del mundo.
En aquella época se calcula que la secuenciación completa del genoma tenía un coste de más de 2 billones de dólares. Sin embargo, gracias al avance de la tecnología, tanto el tiempo para el estudio del exoma como el coste asociado ha ido descendiendo, siendo de unos 200.000 dólares americanos en el año 2008, 10.000 dólares en el 2010 y podría acercarse a los 1.000 dólares en el año 2014.
Ahora bien, hablamos únicamente del coste de la parte tecnológica, ya que hay una parte imprescindible y muy importante de interpretación de la cantidad de datos que aportan estas técnicas, que representa un coste añadido.
Habitualmente nuestro exoma contiene cientos de cambios ocurridos al azar y que, no siempre, tienen una repercusión clínica (no son siempre causa de enfermedad). Por ello es imprescindible filtrar esos cambios que encontramos para saber cuál de todos los hallazgos explicaría la enfermedad que estamos tratando de diagnosticar.
Para esto se recurre al estudio del exoma de los padres o al análisis de las funciones de los genes donde se encuentran los cambios, entre otros.
Esto está dando lugar a la necesidad de utilizar los conocimientos de una disciplina emergente, la bioinformática, para ayudar al clínico o al genetista a interpretar los resultados.
Y si se detecta una mutación, ¿qué pasa después?
Cuando se realiza un estudio de exoma se estudia tanto al paciente (caso índice) como a los progenitores, para ayudar a interpretar los hallazgos.
Cuando se detecta un cambio que puede ser patológico, se realiza la secuenciación Sanger para confirmarlo (la misma que se realiza de forma rutinaria para el estudio de un gen concreto). Muchas veces, es también necesario el estudio de familiares sanos (hermanos o hermanas del caso índice) para confirmar o descartar un cambio como mutación.
La importancia de detectar el gen y la mutación que causan la enfermedad
Saber qué gen está mutado en cada paciente da una confirmación genética al diagnóstico clínico realizado por el médico. Esto permite el consejo genético de una enfermedad hereditaria.
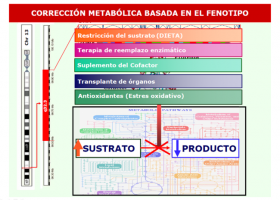
Pero cada vez más, y se cree que en un futuro no muy lejano será así, los fármacos utilizados para tratar ciertas enfermedades genéticas van a ir relacionados con el gen mutado, el tipo de mutación, así como con la presentación clínica del paciente.
Tener un diagnóstico genético lo más precoz posible que confirme el diagnóstico clínico nos permitirá abordar la enfermedad con mucha más información, anticipando presentaciones clínicas mediante estimulación precoz o medicación preventiva, tener un seguimiento del paciente acorde con el tipo de enfermedad, etc.
¿Cuándo se recurre al estudio o secuenciación del exoma?
En la práctica clínica su utilización es limitada, aunque cada vez se está teniendo más accesibilidad a estas técnicas.
Cuando un paciente con una sospecha de ECM presenta un perfil bioquímico y clínico muy sugestivo de un determinado ECM, se suele recurrir a técnicas más rápidas, más económicas y más fáciles de interpretar, como el estudio de un solo gen (guiados por la sospecha bioquímica y clínica) o bien el uso de paneles génicos para un grupo de genes.
Sin embargo, hay algunos ECM en los que el diagnóstico se complica porque el perfil bioquímico no es tan claro o no es característico y las manifestaciones clínicas son variables.
En algunos de estos pacientes, si las técnicas anteriores no resultan concluyentes, se puede realizar un estudio de exoma, insistiendo de nuevo, en la importancia de hacer un buen estudio de interpretación de los hallazgos y teniendo en cuenta también que es una técnica que tiene sus limitaciones.
El criterio de elección del método genético de estudio más adecuado debe estar determinado por la estrecha colaboración entre los clínicos, bioquímicos y genetistas que atienden al paciente.
- 41942 lecturas


![Secuenciación del exoma, primera parte. Foto: SarahKusala en Wikimedia con licencia (CC BY 3.0)]](http://upload.wikimedia.org/wikipedia/commons/0/09/Exome_Sequencing_Workflow_1a.png)
![Secuenciación del exoma, segunda parte. Foto: SarahKusala en Wikimedia con licencia (CC BY 3.0)]](http://upload.wikimedia.org/wikipedia/commons/7/70/Exome_Sequencing_workflow_1b.png)