Investigación clínica en Errores Congénitos del Metabolismo (ECM): ensayos clínicos (I/III)

Un ensayo clínico consiste en la evaluación experimental de un fármaco nuevo, una prueba diagnóstica o una nueva indicación a través de su administración o aplicación en seres humanos, bajo un diseño metodológico que permita obtener resultados muy fiables.
Pretende valorar sus efectos farmacocinéticos (cómo se absorbe, reparte y elimina por el organismo) y farmacodinámicos (cómo funciona dentro del organismo), establecer su eficacia y su seguridad. En la práctica, sirve para aceptar un nuevo tratamiento como más eficaz para mejorar la salud.
¿Requiere un protocolo especial un ensayo clínico?
Es un proceso complicado que requiere un protocolo complejo, que incluya el diseño científico del estudio (antecedentes, hipótesis a comprobar, objetivos) y unos procedimientos a seguir (criterios de incorporación de pacientes, consentimiento informado, recolección de datos, evaluación de resultados, publicación de los mismos…).
Una vez realizado el protocolo, debe ser aprobado por un Comité Ético de Investigación Clínica (CEIC) para poder realizarlo. A partir de que se incluye al primer paciente, se monitoriza su adecuado desarrollo y se recogen exhaustivamente todos los datos clínicos e incidencias.
¿Qué es el Comité Ético de Investigación Clínica (CEIC)?
Es un equipo multidisciplinar formado por médicos, farmacéuticos, enfermería, y personal ajeno a la institución sanitaria (por ejemplo, se incluye siempre a un licenciado en derecho).
El CEIC evalúa todos los aspectos relevantes del estudio (buen protocolo de investigación, investigadores competentes, balance entre riesgos y beneficios, consentimiento informado, selección equitativa de sujetos protegiendo a los más vulnerables, compensación de los posibles daños causados por la investigación), así como los problemas derivados de su aplicación.
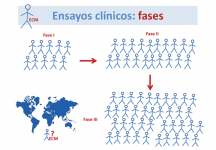
¿Cuáles son las etapas o fases de un ensayo clínico?
El desarrollo y puesta en marcha de un medicamento nuevo es un procedimiento largo y complejo, que pasa por las siguientes fases:
- Ensayo clínico en fase I: proporciona información preliminar sobre la seguridad del producto en un pequeño grupo de indivíduos y orienta sobre la dosis y la pauta de administración más adecuadas para ensayos posteriores (dosis y efectos secundarios).
- Ensayo clínico en fase II: se aplica a un grupo algo mayor de pacientes, para tener información sobre la eficacia del producto en la enfermedad, dosis-respuesta del mismo y ampliar los datos de seguridad.
- Ensayo clínico en fase III: Sirve para evaluar la eficacia en un grupo mucho mayor de pacientes, observar los efectos secundarios y comparar con otros tratamientos comunes o con un placebo (tratamiento sin valor curativo real, excepto por el efecto psicológico).
- Ensayo clínico en fase IV: Se realiza tras la comercialización del medicamento, para aumentar la información sobre riesgos y beneficios a largo plazo y uso óptimo.
¿Qué se requiere para que un ensayo clínico sea éticamente correcto?
El ensayo clínico debe cumplir unos requisitos mínimos:
- Que haya razones para suponer su eficacia (es decir, que sus beneficios se puedan presumir superiores a sus riesgos).
- Que el diseño sea correcto y los investigadores cualificados.
- Que los participantes en el ensayo lo sean con conocimiento de causa y voluntariamente.
- Que no pertenezcan a grupos vulnerables o desprotegidos.
Además, toda la realización del estudio debe seguir las normas de Buena práctica clínica, es decir, el conjunto de normas administrativas que deben respetar los promotores (industria farmacéutica), investigadores y monitores del ensayo clínico, para garantizar que el protocolo sea científicamente adecuado, que se respeten los derechos del paciente y que los resultados sean fiables y puedan ser aceptados por las agencias reguladoras de medicamentos.
¿Es necesario realizar ensayos clínicos en niños?
Los niños constituyen una población única con diferencias fisiológicas y de desarrollo con respecto a los adultos. Los niños no son “mini-adultos”.
Cambian con la edad y el desarrollo, tienen una mayor proporción de agua en su organismo (los fármacos pueden estar más diluidos y ser menos eficaces, pero más tóxicos), la maduración del sistema nervioso es diferente, tienen enfermedades exclusivas o más comunes en la infancia (como las enfermedades metabólicas), los fármacos pueden tener efecto sobre el crecimiento en los niños, etc…
Los ensayos clínicos en niños son esenciales para poder desarrollar terapias e intervenciones específicas para esta edad, verificadas empíricamente (de forma aplicada), y que permitan determinar y optimizar los mejores tratamientos disponibles para ellos.
¿Es ético realizar un ensayo clínico en niños?
Es la única forma de que los niños dispongan de un nuevo fármaco que pueda curarlos o mejorar su salud.
Además de ser metodológicamente correctos, se deben realizar desde unas condiciones legales y éticas muy estrictas, es decir, siguiendo los principios éticos básicos de aplicación práctica en la investigación clínica con seres humanos (Informe Belmont, 1978): beneficencia, autonomía y justicia.
¿Cuál es la labor del investigador en un ensayo clínico en niños?
El investigador acostumbra a ser el médico que lleva al niño y es, en general, un experto en aquella enfermedad que padece y con experiencia en ensayos clínicos.
Se encargará de realizar el diseño conjuntamente con el promotor del estudio (laboratorio farmacéutico), presentarlo al CEIC, seleccionar a los pacientes que van a ser incluidos en el estudio, obtener el consentimiento informado de sus padres o tutores legales y el acuerdo del niño.
Al niño se le explicara el ensayo según su capacidad de asimilación, de manera que pueda entenderlo.
Una vez iniciado el ensayo, el médico/investigador se responsabilizará del buen desarrollo del mismo.
El médico/investigador será el interlocutor principal con el paciente y su familia, tanto en el inicio al informar al paciente y sus familiares del objetivo del estudio, sus características y las molestias que puede comportarles (visitas hospitalarias, pruebas especiales), como en realizar un seguimiento clínico exhaustivo del mismo.
El investigador debe trabajar de acuerdo con las normas de la Buena práctica clínica que protegen los derechos, la seguridad y el bienestar del paciente, garantizan que los datos recogidos son precisos y los resultados son fiables.
Debe minimizar el impacto del ensayo clínico sobre el paciente y su familia, estando disponible ante cualquier contingencia.
La confianza que tenga el paciente y su familia en su médico/investigador es básica en la aceptación del estudio por parte de ellos y también en su buena marcha.
¿Qué dificultades especiales tienen los ensayos clínicos en ECM?
Los ECM son enfermedades minoritarias (raras), con unas frecuencias individuales muy bajas. Esto dificulta especialmente la realización de ensayos clínicos en estas enfermedades.
Los pocos pacientes de una enfermedad determinada diagnosticados y seguidos en un hospital acostumbran a ser de edades diferentes, con una heterogeneidad clínica y genética que hace muy difícil la interpretación de los resultados. Ello obliga a realizar estudios multicéntricos (que implican diferentes hospitales), que siempre presentan mayores dificultades debido a la diversidad de culturas y prácticas clínicas.
No obstante, los tratamientos específicos de muchas de estas enfermedades se han podido comercializar después de la realizar ensayos clínicos multicéntricos concluyentes.
Además, en muchos ECM aún sin tratamiento se están llevando a cabo actualmente ensayos clínicos de nuevas terapias.
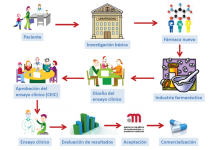
¿Qué papel tienen las Asociaciones de pacientes/padres con enfermedades minoritarias (como los ECM) en la investigación de tratamientos nuevos?
Las Asociaciones de pacientes /padres tienen un papel decisivo en la motivación de la comunidad científica para que se interese y dedique sus energías y tiempo a hallar tratamientos nuevos para las enfermedades minoritarias.
Las asociaciones están cada vez más implicadas en colaborar con la comunidad científica, en el registro de pacientes y en la obtención de fondos que permitan la investigación en estas enfermedades.
Dicha investigación se lleva a cabo habitualmente en centros universitarios o de investigación básica, y es transferida a los laboratorios farmacéuticos sólo cuando los resultados son aceptables.
Estos laboratorios se encargan del proceso de puesta a punto del fármaco, de la colaboración con los investigadores médicos que van a llevar a cabo los ensayos clínicos necesarios para su aceptación por la Agencia Española del Medicamento (en España) y de su comercialización posterior.
Los ensayos clínicos pueden ser subvencionados también mediante becas de investigación pública, como el Fondo de Investigación Sanitario (FIS) y otros.
También es básica la colaboración de los padres y tutores para la realización de los ensayos clínicos, ya que estos requieren unas condiciones estrictas de seguimiento, que serán indispensables para la validez de los resultados.
Dado el largo y complejo proceso que constituye la investigación de un fármaco nuevo hasta su comercialización, que puede prolongarse durante años, es especialmente remarcable el papel de muchos padres de pacientes con enfermedades graves, a veces neurodegenerativas, que a través de las asociaciones colaboran arduamente, aún sin saber si a la larga su hijo podrá llegar a beneficiarse del nuevo tratamiento.
Drs. Antoni Noguera (Servicio de Pediatría), Francisco José Cambra (Unidad de Cuidados Intensivos) y Equipo Guía Metabólica
- 2473 lecturas