¿Qué relación tienen los mecanismos epigenéticos con el ADN?

La epigenética se refiere a los mecanismos celulares que controlan la expresión de genes sin alterar directamente la secuencia de ADN que estos genes incluyen. En este sentido, cabe referenciar que el término epigenético hace alusión a que está por encima de la genética.
El ADN en la célula se localiza en el núcleo, desde donde salen unos hilos a los que, generalizando, llamamos cromatina (una especie de "madeja" que representa estos hipotéticos hilos de ADN). Es precisamente en la cromatina donde suceden los cambios epigenéticos, ya que éstos no son codificados por el genoma (ADN).
La cromatina es una estructura dinámica y cambiante. Pero los cambios en la cromatina (que hacen que el ADN se pueda leer o no) pueden también heredarse, como se hereda la secuencia de ADN. Sin embargo, esta regulación heredable de la expresión, o lectura de los genes, puede ser parcialmente reversible porque no implica mutaciones, sino cambios químicos.
Regulación de los mecanismos epigenéticos
Se describen tres fenómenos epigenéticos que regulan la lectura o expresión de ADN:
- La metilación del ADN.
- Las modificaciones de las histonas.
- Los microARN (miRNA) no codificantes.
Los mecanismos epigenéticos son continuos, dinámicos y están involucrados en el desarrollo normal de los humanos. Así, la información genética, o secuencia de ADN, que tiene una célula de nuestra retina es la misma que la que tiene una célula de nuestra piel o de nuestra sangre. Pero es por los mecanismos epigenéticos que actúan sobre su ADN que esas células, al final, van a ser para siempre diferentes.
Los mecanismos epigenéticos alterados son también la causa de enfermedades reconocidas, como el síndrome de Prader Willi o el síndrome de Silver Russell. Pero en otros casos, los mecanismos epigenéticos nos ofrecen la posibilidad de regular el mecanismo de algunas enfermedades para mejorar su control o su pronóstico.
Además, hay cambios en nuestra epigenética que se producen de forma precoz, y que favorecen que, en la edad adulta, tengamos predisposición a determinadas enfermedades. En este sentido hay evidencias de que una buena alimentación en la infancia produce cambios estables en nuestra epigenética que determinará nuestro riesgo cardiovascular o de intolerancia a los azúcares cuando seamos mayores.
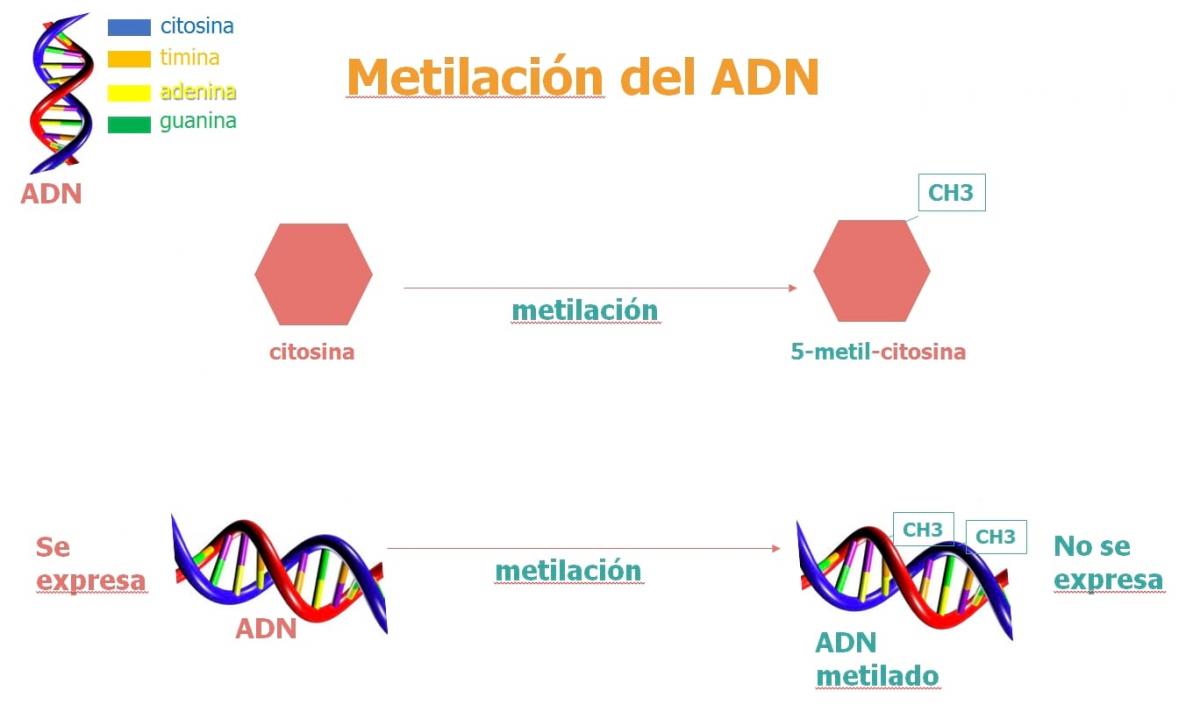
1. Metilación del ADN
La metilación del ADN es una modificación epigenética que implica que un grupo metilo se inserta en una de las “letras” del ADN: la citosina.
La hipermetilación del ADN compacta la cromatina (la "madeja") y los genes de esa posición hipermetilada no se pueden leer con normalidad. Cuando baja la metilación del ADN, se produce una apertura de la cromatina, de forma que puede entrar la maquinaria y se puede leer el gen.
La modificación epigenética del ADN, concretamente la metilación, juega un papel crítico en el establecimiento y el mantenimiento de tipo celular (que cada célula de nuestro cuerpo tenga la misma información, pero diferente estado epigenético).
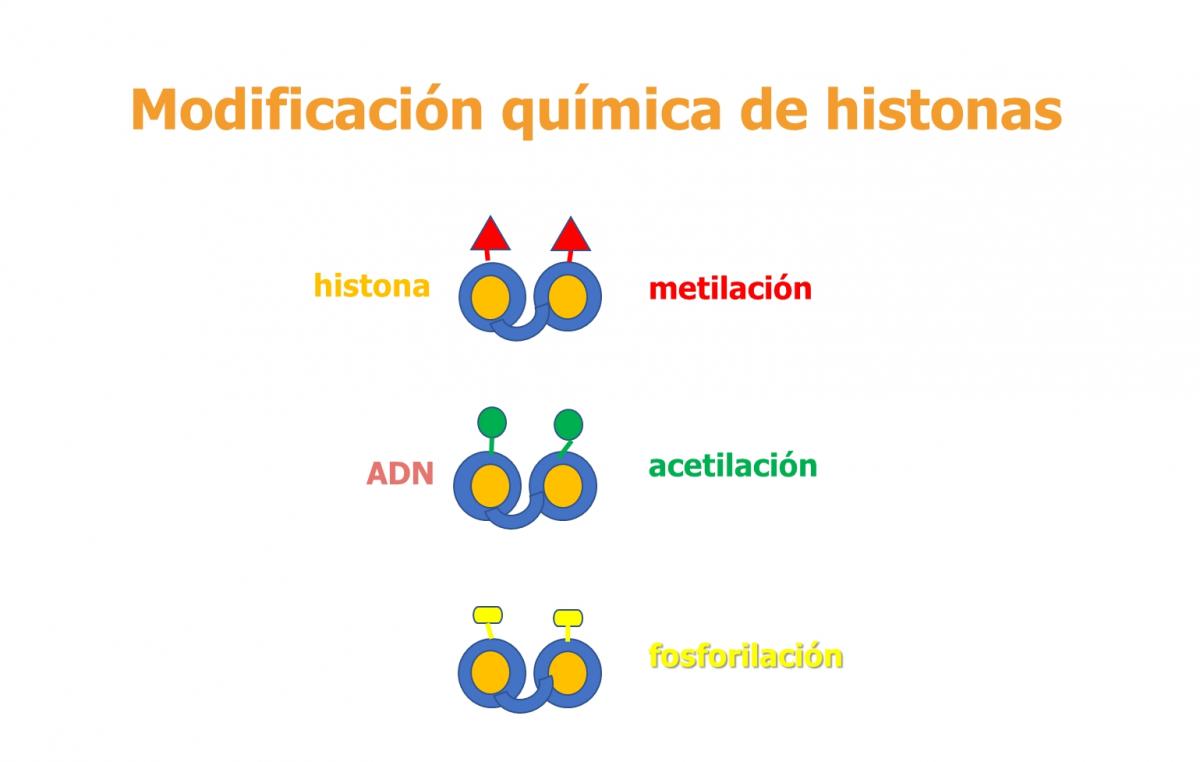
2. Metilación de histonas
Las histonas son unas proteínas sobre las que se enrolla la cadena de ADN, empaquetándola. Simbólicamente, sería el "carrete" sobre el que se enrolla la "madeja".
Mediante cambios químicos de estas histonas se puede conseguir que se produzca un empaquetamiento mayor de la madeja a su alrededor, de forma que no permita la lectura del ADN o, al contrario, que se produzca una apertura que facilite esa lectura.
Las histonas compactan ADN cuando se metilan (un proceso químico por el que se les unen grupos metilo). Al contrario, la acetilación en las colas de las histonas produce una apertura de la cromatina (la "madeja"). Además de estos dos procesos o cambios químicos (la acetilación y la metilación) de las histonas, hay otros procesos químicos, como la fosforilación y la carboxilación. Todos estos procesos químicos en equilibrio determinan ese cierre o apertura de la cromatina para que el ADN sea silenciado o se pueda leer.
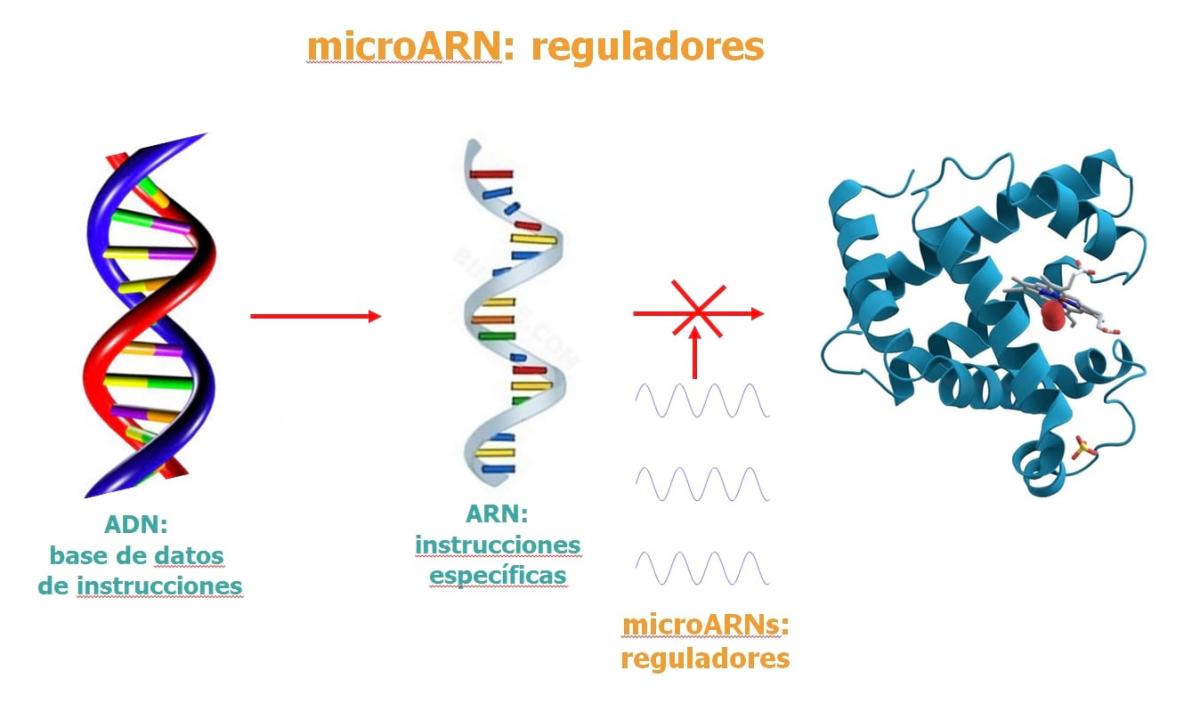
3. Los ARNmi
Los ARNmi, o microARN, son pequeñas moléculas de ARN que regulan la expresión génica.
Si la metilación del ADN y los cambios en las histonas hacen que la hebra de ADN se compacte más o menos y determinan la accesibilidad de la maquinaria de lectura, en el caso de los ARNmi lo que ocurre es que estas pequeñas moléculas interceptan la copia de ADN que sale del núcleo (ARN mensajero) y no le dejan llegar a su destino. De forma que, a efectos prácticos, es como si no se hubiera llegado a leer el ADN.
Los ARNmi reconocen el ARN mensajero cuando sale del citoplasma y se unen a él. Así pueden provocar su degradación o almacenamiento en vesículas, causando una inactivación o silenciamiento porque no llegará a formar una proteína.
En el caso de los humanos, los ARNmi son cientos de moléculas diferentes. Hasta la fecha se han descrito más de 3.500 ARNmi maduros que se registran en la miRBase.
Para algunas enfermedades hay paneles de ARNmi en el mercado que determinan perfiles específicos y que aportan un gran valor diagnóstico y pronóstico, es decir, permiten diferenciar entre aquellas enfermedades que evolucionarán dentro de su grupo con mayor agresividad o que responderán mejor a la quimioterapia. Ofrecen una “firma” de ARNmi que nos aporta información clínica.
Conocer en detalle los mecanismos epigenéticos que están implicados en cada persona y en cada enfermedad y desarrollar herramientas para poder modificarlos permitirá mejorar el curso de las enfermedades y, en algunos casos, curarlas. Los avances en medicina en este campo son incesantes y esperanzadores.
Varios ensayos clínicos están en la actualidad en marcha utilizando agentes que modifican la metilación del ADN, que cambian las propiedades de las histonas o que modifican la actividad de los ARNmi, o utilizando varias estrategias epigenéticas a la vez.
- 25658 lecturas