El Consentimiento Informado, un proceso importante para pacientes y profesionales de la salud
Consentimiento es la manifestación de la voluntad libre y consciente válidamente emitida por una persona capaz, o por su representante autorizado, precedida de la información adecuada (Ley de Investigación biomédica, 14/2007).
La información previa al consentimiento debe darse de palabra y por escrito, de manera que la persona que lo otorga se sienta plenamente informada y pueda dar libremente su consentimiento de palabra o por escrito, según los casos.
¿Debemos diferenciar lo que es verdaderamente el CI del documento en que se expresa?
El CI es un proceso de información al paciente o a su representante, explicándole, de modo comprensible,
- Qué es lo que se le pide.
- Cómo se va a llevar a cabo.
- Quién y cómo va a proteger sus intereses.
- En qué condiciones se van a conservar su muestra y/o sus datos.
- Cuáles son los posibles inconvenientes que se pueden derivar para él.
- Que tiene derecho a revocar su autorización inicial y a quién debe dirigirse para ello y para cualquier pregunta que desee hacer (art 59 Ley 14/2007).
Este proceso culmina con la firma del documento de consentimiento informado, una vez que el paciente, adecuadamente informado, autoriza la realización del proceso.
¿En qué procesos médicos se requiere el CI?
En muy diversos procesos médicos, que pueden estar implicados en el diagnóstico, tratamiento, obtención de datos y/o muestras biológicas destinadas a la investigación biomédica.
¿Para todos los procesos médicos se requiere un CI?
Para muchos procesos diagnósticos, tales como el examen físico, la obtención de muestras de sangre y orina para análisis bioquímicos de diagnóstico o control o la realización de exploraciones complementarias no invasivas, el consentimiento es tácito y se da por sobreentendido.
Pero cuando los procedimientos son más invasivos o implican riesgos potenciales o resultados inciertos o bien cuando existen alternativas, en pruebas de diagnóstico genético y en investigación, el CI se debe pedir por escrito, acompañado de una información previa suficiente (oral y escrita) y debe ser firmado por el paciente o sus representantes.
En general, se considera que es diferente ser sujeto de investigación (ensayos clínicos para nuevos procedimientos diagnósticos o tratamientos), que ceder los datos clínicos o muestras biológicas para la investigación biomédica. El primer caso puede implicar un riesgo para el paciente, mientras que en el segundo (por ejemplo, estudios genéticos) el CI se solicita por la necesidad de confidencialidad y de conocimiento por parte del dador de los resultados del estudio.
¿Por qué hay que solicitar un Consentimiento Informado?
Para respetar a los pacientes como personas humanas y a sus preferencias en cuidados médicos y a fin de evitar los posibles abusos que se habían dado en determinadas investigaciones en seres humanos, se habían establecido una serie de declaraciones, como la de Nürenberg (1947), la de Derechos Humanos (1948).
La declaración de Helsinki (1964/1975/2000) destaca que las consideraciones sobre el bienestar de los individuos participantes deben prevalecer sobre cualquier interés o beneficio colectivo de la sociedad o de la ciencia. Los principios del Informe Belmont (1978) se han generalizado como guía de conducta ética.
¿Cuáles son los principios bioéticos que apoyan la necesidad del CI?
Los tres primeros corresponden al Informe Belmont:
(1) Principio de autonomía
Respeto por la dignidad de la persona. Las personas deben tomar sus propias decisiones en relación con su salud. No se puede aplicar un procedimiento médico al paciente ni vulnerar su privacidad sin su consentimiento. Las personas vulnerables (con autonomía reducida) requieren una mayor protección.
Esto supone que no se puede utilizar sus datos o sus muestras biológicas sin su consentimiento y que hay que tratar datos y muestras con respeto. Los profesionales son responsables de la custodia de las muestras pero no son sus propietarios. Los datos y muestras se deben obtener y almacenar en condiciones adecuadas, con competencia profesional, explicar al paciente el proyecto que se propone hacer con sus datos y muestras y pedirle autorización, es decir, obtener su Consentimiento Informado.
(2) Principio de beneficencia
Podemos identificar cuatro niveles, de menor a mayor compromiso: no hacer el mal, evitar el mal, hacer el bien, promover el bien. Debemos tener en cuenta que el interés del paciente debe prevalecer sobre los intereses de la ciencia y de la comunidad.
(3) Principio de justicia
Implica un reparto equitativo de cargas y beneficios.
A estos principios podemos añadir otros:
(4) Principio de solidaridad
El fin de la investigación biomédica consiste en incrementar los conocimientos sobre enfermedades y sobre la biología del ser humano, para aplicarlos en beneficio de los enfermos en un futuro próximo. El objetivo es mejorar la capacidad de curar las enfermedades, adaptar los tratamientos a las personas y aliviar el sufrimiento.
En el caso de las enfermedades minoritarias (raras) , como las enfermedades metabólicas, el reducido número de pacientes afectos de cada una de ellas hace aún más importante la colaboración entre los pacientes y sus familiares, ya que todos esperan un tratamiento para aliviar su situación, lo que hace necesaria, casi imprescindible, la investigación para mejorar nuestro conocimiento de estas enfermedades y de su tratamiento.
El ser humano es social y todos nos beneficiamos de los conocimientos adquiridos anteriormente. Cuando un paciente se ha beneficiado de unos conocimientos, de unos medios, de un sistema, para su diagnóstico y tratamiento, se considera que tiene el deber moral de colaborar en la extensión de estos beneficios a otros, siempre que ello no le suponga ningún perjuicio.
El respeto por la autodeterminación del individuo y por su privacidad puede conjugarse con la colaboración con otros para obtener beneficios mutuos, como pueden ser el conocimiento biomédico y nuevas oportunidades de tratamiento. De todos modos, este principio presenta una marcada diferencia con los anteriores, ya que no se puede imponer.
(5) Principio de responsabilidad
El médico o investigador tiene la responsabilidad de llevar a cabo investigación para seguir en la línea de servicio a los pacientes. Pero también tiene la responsabilidad de proteger a las personas ante posibles daños si ve un peligro para ellas, aún en el caso de que lo autorice el CI que hubieran firmado.
(6) Principio de gratuidad
Las muestras biológicas, particularmente de tejido humano, no pueden venderse, pero pueden ser donadas. En todo caso, es recomendable cubrir los gastos que pueda acarrear la investigación a las familias implicadas (por ejemplo, desplazamientos, etc.).
¿Cómo debe ser la información que se proporciona al paciente?
La comunicación de la información es un procedimiento necesario, que requiere tiempo, dedicación, tranquilidad y un clima de confianza, por lo que es difícil de asumir en el proceso asistencial habitual.
Requiere también la formación adecuada de las personas que comuniquen esta información.
Se debe animar al paciente/padres o tutores a que pregunten las dudas o los aspectos que puedan no haber entendido bien.
Según los casos se puede explicar en una primera entrevista y firmar el consentimiento en una segunda, después de meditar sobre ello.
¿Qué aspectos debe recoger el CI?
En esta tabla podemos ver los aspectos más relevantes que debe recoger todo documento de Consentimiento Informado.
¿En el caso de la obtención de muestras biológicas, el CI debe ser amplio o específico?
Un CI específico es el que se solicita para la obtención de datos o muestras para la realización de un proyecto de investigación determinado.
Un CI amplio se solicita para un proyecto y “proyectos relacionados” o para investigación biomédica, en general, con conservación de la muestra en un biobanco, sin limitarlo a un tipo determinado de investigación.
En el documento de CI se pueden (y deben) ofrecer alternativas, que especifiquen si se autoriza la investigación para una determinada enfermedad o bien para todas las enfermedades, para asegurar el derecho a elegir del donante.
¿Qué función tiene el Comité Ético de Investigación Clínica (CEIC) en relación con el CI?
La función del CEI es de importancia capital, ya que vela para que se respete la autonomía del paciente en el tema del CI, que se cumplan los requisitos de confidencialidad y que el proyecto le garantice un riesgo mínimo.
El CEI tiene potestad para decidir que un proyecto no reúne las condiciones necesarias para utilizar las muestras o datos que solicita y su decisión es vinculante. En la información que se ofrece a los pacientes el CEI es el garante de que todos los proyectos en que se vayan a utilizar sus muestras/datos se examinarán cuidadosamente, para asegurar su correcto desarrollo.
¿Qué problemas presenta el CI en menores o pacientes no competentes?
En los casos de menores o pacientes no competentes el CI es otorgado por terceros: sus padres o tutores.
En el caso de los menores, existe una maduración progresiva de forma que su capacidad de comprensión y de decisión autónoma va aumentando progresivamente. A medida que se va haciendo capaz de entender, hay que darle la información adecuada que pueda comprender y obtener su asentimiento.
En general, se consideran tres rangos de edad: niños menores de 7 años (el CI lo dan padres o tutores), de 7-12 años (se les debe dar una explicación suficiente para que entiendan el estudio) y mayores de 12 años.
Estos últimos (cuando se considera que son suficientemente maduros pueden opinar antes) deben firmar el CI, si no tienen objeción a lo que se les ha propuesto, después de proporcionarles información comprensible. En el documento de CI se les indica que, al llegar a la mayoría de edad (si entonces son competentes), pueden ejercer su derecho de revocación (de hecho, pueden ejercerlo antes). Pero si no lo ejercen, se considerará válido el CI vigente.
¿En el diagnóstico de un error congénito del metabolismo (ECM), para qué procedimientos se solicita habitualmente el CI?
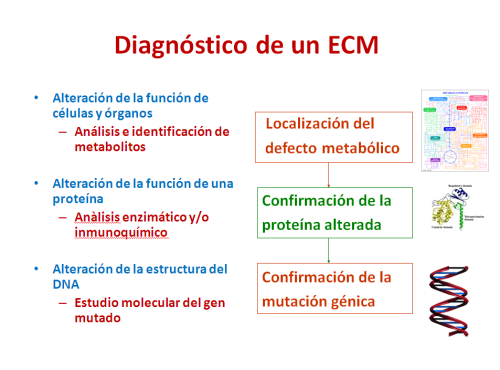
Dado que son enfermedades genéticas que afectan al metabolismo, su diagnóstico requiere en muchos casos un estudio de la función de la proteína, enzimática o de transporte, que está alterada debido a las mutaciones en el gen que la codifica. Para ello se requiere, en muchos casos, la obtención de biopsias de piel (para cultivo de fibroblastos), músculo u otros tejidos (por ejemplo, en enfermedades mitocondriales), previa solicitud del CI.
Una vez localizada la proteína alterada, la confirmación del diagnóstico de un ECM se realiza mediante el estudio genético, del paciente y sus padres, generalmente portadores (en enfermedades autosómicas recesivas). Este estudio se realiza, en general, en DNA extraído a partir de sangre periférica o de tejidos.
El DNA del paciente nos informa no solo de las posibles mutaciones del gen en estudio, sino también de todo el resto del genoma del paciente, con las posibles alteraciones en otros genes, que pueden ser predictivas, es decir, causantes de enfermedades del adulto y susceptibilidad a otras enfermedades, así como también del carácter de portador de las mismas.
Hay que considerar que las pruebas genéticas son para toda la vida, tienen implicaciones familiares y generacionales y pueden ser determinantes para la toma de decisiones en el diagnóstico prenatal. Además, la información genética puede ser identificativa. Por todo ello, antes de realizar un estudio genético se debe solicitar un CI.
Otros procedimientos diagnósticos que requieren en general un CI son las pruebas dinámicas, como las sobrecargas con diferentes metabolitos, para alcanzar el diagnóstico de nuevas enfermedades o el diagnóstico diferencial entre ellas (por ejemplo: el test de alopurinol en la deficiencia de OTC), o bien para demostrar la respuesta a nuevos tratamientos (por ejemplo, la prueba de sobrecarga de BH4 en la PKU).
¿Se utiliza el CI también para el tratamiento de los ECM?
Los ECM son enfermedades minoritarias, que se tratan en general con fármacos huérfanos, que presentan ciertas peculiaridades comparados con los medicamentos comercializados en oficinas de farmacia. Por ello se solicita, muchas veces el CI antes de la aplicación de algunos de dichos fármacos.
La misma situación es aplicable al uso de medicamento de uso compasivo, es decir, fármacos que ya están en el mercado pero que, en ciertas enfermedades, se utilizan con fines no incorporados en su ficha técnica.
Este consentimiento informado, de forma especial en el caso de fármacos huérfanos y de usos compasivos, debe asociar una explicación del facultativo que considera que es adecuado iniciar el tratamiento, ya que, con mayor frecuencia en estas situaciones, la disponibilidad de información para el paciente es limitada.
Dra. Victòria Cusí. Jefa del Servicio de Anatomía Patológica, Hospital Sant Joan de Déu - Barcelona y Equipo Guía Metabólica.
- 96752 lecturas