Trasplante de hígado en errores congénitos del metabolismo

El trasplante de hígado consiste en reemplazar el hígado dañado de una persona por un hígado sano de otra. La persona que da el hígado se llama donante y la que lo recibe, receptor.
Este tipo de trasplante, de una persona a otra, se llama trasplante alogénico o alotrasplante. Hablamos de trasplante ortotópico cuando el hígado del paciente es reemplazado por el hígado del donante en la posición anatómica original.
El hígado sano se obtiene, en general, de un donante que haya fallecido, que cumpla una serie de requisitos y que no haya sufrido lesión hepática.
Pero en algunos casos, un donante vivo puede donar una parte de su hígado a un miembro de su familia o amigo que lo requiera. En este caso se trataría de un trasplante parcial de hígado.
El trasplante hepático se implementó inicialmente para situaciones que cursaban con fallo hepático, con elevado riesgo vital del paciente a corto plazo y por lo que la evaluación del riesgo-beneficio estaba claro.
Pero a medida que se han perfeccionado los procedimientos, reduciéndose los riesgos del trasplante y mejorándose los resultados post-operatorios, se ha convertido en una opción terapéutica a considerar en un creciente número de errores congénitos del metabolismo.
¿En qué se basa la utilidad del trasplante de hígado en ECM?
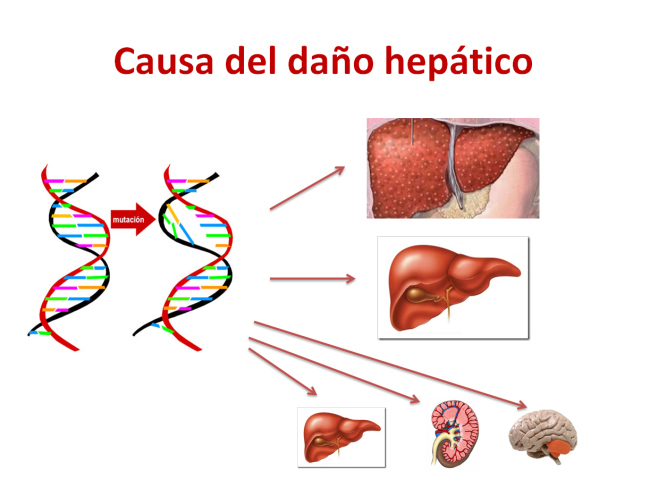
Considerando la causa del daño hepático de los ECM, su tratamiento mediante trasplante de hígado se basaría en tres características principales:
- Que el ECM cause lesión hepática progresiva que acaba conduciendo a cirrosis e insuficiencia hepática, lo que hace que el trasplante hepático sea un procedimiento vital.
Es el caso de la enfermedad de Wilson, la deficiencia de α-1-antitripsina, las glucogenosis tipos Ia/b y IV y los trastornos de síntesis y transporte de los ácidos biliares. La tirosinemia tipo I estaba en esta categoría antes de aparecer el tratamiento con nitisinona; el trasplante en esta enfermedad se plantea solo en casos seleccionados que tienen mala respuesta al tratamiento. - Que el gen mutado se exprese solo en hígado, con lo que la sustitución del hígado afectado por uno no afectado cura la enfermedad. En este grupo se incluirían trastornos del ciclo de la urea por déficit de ornitina transcarbamilasa. Otros ejemplos serían la hiperoxaluria primaria, la hipercolesterolemia familiar, el síndrome de Crigler-Najjar y algunas glucogenosis hepáticas.
- Que el gen mutado se exprese mayoritariamente en hígado, pero también en menor proporción en otros órganos o tejidos, como en los defectos citosólicos del ciclo de la urea (citrulinemia, aciduria arginosuccínica y argininemia), enfermedad de jarabe de arce y acidurias orgánicas.
En el caso de este tercer grupo de ECM, la sustitución del hígado afectado puede resolver parcialmente el problema, ya que es una fuente de actividad enzimática que puede corregir el equilibrio metabólico en otros órganos. No obstante, puede no evitar la liberación parcial de metabolitos tóxicos que pueden dañar a largo plazo a otros órganos, como riñón o el cerebro. En estos casos, se plantea mantener cierta restricción dietética tras el trasplante.
Considerando la efectividad del tratamiento con trasplante de hígado en los ECM, podemos distinguir (basándonos en Mazariegos G y col, Mol Genet Metab 2014;111(4): 418-27):
- ECM en los que el trasplante de hígado tiene un efecto curativo.
- ECM que mejoran con el trasplante de hígado.
- ECM que merecen una consideración especial.
Enfermedades metabólicas en las que el trasplante de hígado tiene un efecto curativo
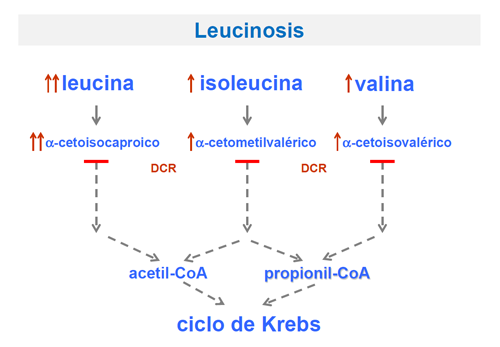
La Enfermedad de orina con olor a Jarabe de Arce o Leucinosis
Se acumulan los aminoácidos y cetoácidos ramificados debido a la deficiencia del complejo descarboxilasa de los cetoácidos ramificados.
A pesar de que el diagnóstico precoz y el tratamiento dietético estricto permiten un crecimiento y desarrollo prácticamente normales, el riesgo de descompensaciones metabólicas debido a enfermedades recurrentes o estrés fisiológico pueden causar una intoxicación metabólica que deteriore la función neurológica.
El riesgo de crisis metabólicas y edema cerebral a pesar de un control metabólico óptimo, plantea la posibilidad de trasplante de hígado en la enfermedad de jarabe de arce clásica.
El trasplante de hígado tiene muy buen pronóstico en este ECM, permitiendo abandonar la dieta restringida en proteínas, la fórmula especial, los suplementos de isoleucina y valina y calorías.
El trasplante protege al receptor de crisis catabólicas, estabiliza la función neurológica, reduciendo o eliminando el riesgo de accidentes cerebrovasculares y edema cerebral. No obstante, no revierte la afectación neurológica ya existente antes del trasplante.
El trasplante dómino (utilizar el hígado del receptor para otros pacientes con enfermedad hepática) se ha realizado en pacientes con este ECM con éxito, no observándose elevación de metabolitos tóxicos en el receptor del hígado.
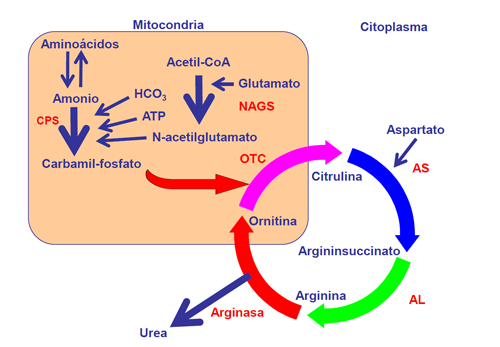
Defectos del Ciclo de la Urea
Los Defectos del Ciclo de la Urea están causados por la deficiencia de una de las seis enzimas que constituyen el ciclo de desintoxicación de amonio o bien uno de los transportadores implicados en el ciclo.
Los tres primeros defectos son mitocondriales y acostumbran a presentarse en el período neonatal, con hiperamonemia grave y mal pronóstico. A pesar de un control metabólico estricto las descompensaciones metabólicas pueden ser graves.
Los tres defectos citosólicos, aunque pueden presentarse también en el período neonatal, tienen un control metabólico más fácil y un mejor pronóstico.
Por ello, en los primeros defectos mitocondriales (especialmente las deficiencias de carbamil fosfato sintetasa y ornitina transcarbamilasa) el tratamiento mediante trasplante de hígado se plantea desde un inicio, siendo el tratamiento clásico (diálisis o hemofiltración, seguidos de dieta restringida en proteínas y agentes quelantes del amonio) un puente hacia el trasplante hepático tan pronto como sea posible.
En cambio, en los defectos citosólicos, el tratamiento clásico es la primera opción terapéutica.
No obstante, el consenso actual del Consorcio de Defectos del Ciclo de la Urea (EEUU) en casos neonatales con defecto enzimático grave (excluyendo los defectos de N-acetilglutamato sintetasa y arginasa, menos graves) recomienda al diagnóstico:
- Tratamiento agresivo y estabilización.
- Poner en lista de espera de trasplante hepático.
Los protocolos europeos no son tan drásticos en la citrulinemia y aciduria arginosuccínica y recomiendan considerar el trasplante hepático solo en pacientes seleccionados.
No obstante, el trasplante hepático básicamente tiene un efecto detoxificante del amonio, pero no afecta otros aspectos neurometabólicos, de forma que es necesaria la suplementación con metabolitos intermediarios del ciclo, como la arginina.
ECM que mejoran con el trasplante de hígado
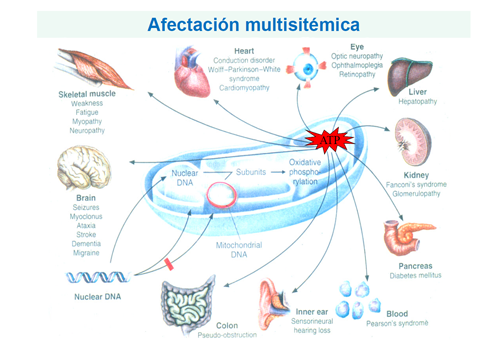
Las enfermedades mitocondriales que dan lugar a un fallo hepático agudo, esteatosis hepática (hígado graso), cirrosis o disfunción hepática intermitente
En su mayor parte están causadas por deleciones del DNA mitocondrial (causadas por mutaciones en los genes POLG, DGUOK, MPV17, SUCLG1, y Twinkle) o por mutaciones en genes nucleares que afectan funciones mitocondriales específicas (cadena respiratoria, transcripción, ensamblaje o traslación mitocondriales). No existe tratamiento curativo específico sino solo terapias de soporte (evitar fármacos tóxicos, optimizar la nutrición, antioxidantes, coenzima Q y L-carnitina).
El trasplante hepático corrige la función hepática, pero ni estabiliza ni normaliza la función mitocondrial en órganos extrahepáticos afectados. Por ello, el trasplante está contraindicado en pacientes con manifestaciones sistémicas graves de la función mitocondrial.
En pacientes con hepatopatía mitocondrial se debe realizar una evaluación multiorgánica (CNS, sistema nervioso periférico, corazón, músculo, retina, intestino) antes de plantearse la posibilidad del trasplante hepático, que solo puede ser útil en pacientes muy seleccionados.
Acidemias propiónica y metilmalónica
Causadas por defectos enzimáticos (propionil-CoA carboxilasa, metilmalonil-CoA mutasa y CblC) en las vías catabólicas de algunos aminoácidos (treonina, valina, isoleucina y metionina). Las formas neonatales graves se presentan con hiperamonemia, cetoacidosis y deterioro neurológico que puede tener un desenlace fatal.
El trasplante de hígado conlleva la estabilización metabólica, mejora la implicación cardíaca, parece mejorar el retraso del desarrollo y mejora la calidad de vida al permitir una restricción dietética menos severa. No obstante, no previene ciertas complicaciones neurológicas ni renales (aciduria metilmalónica).
Actualmente, se ha valorado el riesgo beneficio del trasplante hepático en las acidemias propionicas y se aconseja trasplantar a estos pacientes. Previamente, habrá que descartar posibles afectaciones neurológicas, cardíacas o renales para saber si es un posible candidato.
El trasplante combinado de hígado y riñón se puede considerar en la aciduria metilmalónica con afectación renal previa.
ECM que merecen consideración especial
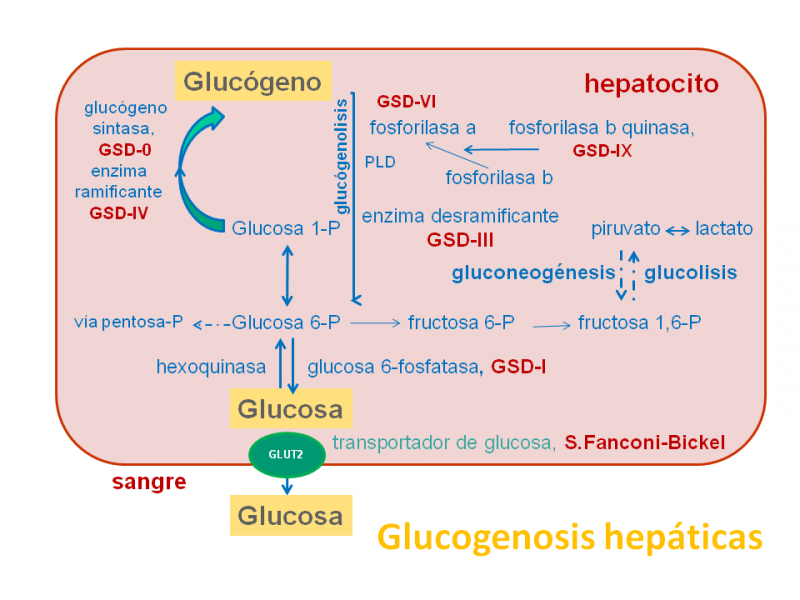
Las glucogenosis hepáticas, que incluyen los tipos I, III, IV, VI y IX, pueden causar una hepatopatía grave. En las glucogenosis Ia y b pueden aparecer adenomas hepatocelulares que deriven a hepatocarcinoma o cirrosis y también en la glucogenosis III y IV algunos pacientes derivan a cirrosis o hepatocarcinoma. Las glucogenosis VI y IX son mucho menos graves.
Aunque el trasplante corrige el defecto enzimático hepático primario, las manifestaciones extrahepáticas (afectación renal en glucogenosis I, cardíaca y miopatía en la IIIa y en la IV, etc.) pueden complicar el manejo post-trasplante.
Se debe considerar el trasplante en las glucogenosis hepáticas con mal control metabólico a pesar del tratamiento clásico, con múltiples adenomas, cirrosis progresiva o fallo hepático.
¿Cuáles son las indicaciones del trasplante de hígado en ECM?
El trasplante de hígado representa entre un 15 – 25% de las indicaciones terapéuticas en enfermedades metabólicas pediátricas y parece que su resultado es mejor que en otras enfermedades hepáticas crónicas, como la cirrosis por otras causas.
La supervivencia a los 10 años de la intervención es superior al 90%, según la literatura médica, y del 97% según la experiencia del Children's Hospital de Pittsburgh (Estados Unidos).
Se debe plantear el trasplante de hígado en tres supuestos:
- El ECM causa lesión hepática estructural (por ejemplo: cirrosis, tumores, etc.).
- El ECM se expresa solo en hígado o también en otros tejidos.
- La gravedad de las características clínicas del ECM.
Se deben considerar además:
- Se debe conocer la historia natural de la enfermedad.
- El impacto de la enfermedad metabólica en el paciente y su familia.
- El desarrollo de posibles opciones terapéuticas actuales y en un futuro próximo.
La especificidad del ECM y la expresión de su fenotipo (características clínicas) determinan la urgencia del trasplante, las opciones quirúrgicas y las posibilidades terapéuticas.
¿Tiene limitaciones del trasplante de hígado en los ECM?
Aparte del limitadísimo número de hígados de donante (que en parte puede mejorar con el trasplante de donante vivo o con el trasplante parcial de hígado), hay que considerar el riesgo que representa una intervención quirúrgica importante en muchos ECM y el riesgo asociado a los fármacos inmunosupresores que tendrá que tomar post-trasplante.
Se debe evaluar el riesgo-beneficio en todos los casos.
¿Qué ventajas tiene actualmente el trasplante de hígado en ECM?
La creciente experiencia en los procedimientos quirúrgicos ha incrementado la supervivencia post-trasplante.
La constatación de que los pacientes con buen control metabólico antes del trasplante tenían mejor resultado quirúrgico que los mal controlados ha incrementado la colaboración de los equipos médicos de seguimiento y los equipos quirúrgicos.
Estas consideraciones han determinado que no solo se considere el trasplante como medio de salvar la vida del paciente, sino también como procedimiento para aumentar su calidad de vida.
¿Qué es el trasplante hepático dómino?
Trasplante hepático dómino es aquel en que el receptor de un hígado sano es a su vez donante de su hígado estructuralmente sano, pero con un problema concreto, por ejemplo, un ECM causado por un defecto enzimático.
El nuevo hígado sano protege metabólicamente a todo el organismo del paciente receptor con ECM e, igualmente, el receptor del hígado con ECM puede compensar el defecto enzimático hepático mediante la actividad enzimática normal expresada en los otros órganos, corrigiendo así el efecto metabólico del defecto hepático.
Esta modalidad de trasplante facilita la obtención de un hígado en pacientes con determinados ECM, que afecten solo a una función concreta, sin causar lesión estructural al hígado. De todas formas, la experiencia en pediatría es muy limitada.
Trasplante parcial de hígado en ECM
El trasplante parcial consiste en la sustitución de una parte del hígado (unos 2 segmentos) de donante al enfermo de ECM. Esto convierte al receptor en un portador sano del defecto enzimático.
Hay que considerar que un padre o madre portadores, que ya tiene su actividad enzimática teóricamente reducida en un 50% no son quizás los donantes óptimos para este tipo de intervenciones.
Trasplante combinado de hígado y riñón
Puede resultar preferible al trasplante aislado de hígado o de riñón en la glucogenosis tipo I, en la acidemia metilmalónicay en la hiperoxaluria primaria.
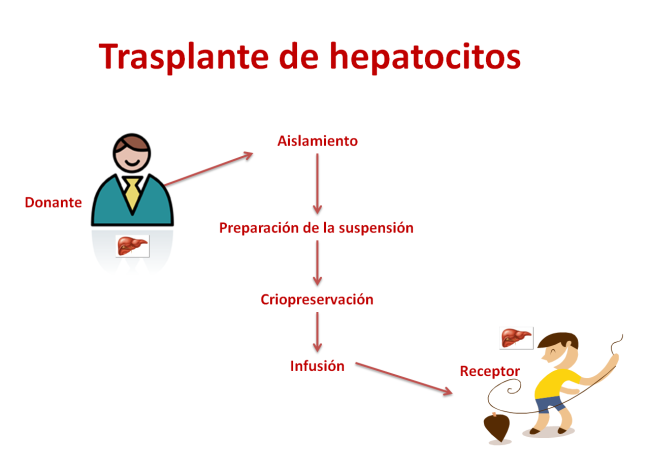
¿Qué es el trasplante de hepatocitos?
Consiste en la transferencia de células hepáticas aisladas en suspensión al hígado enfermo en cantidad suficiente para que sobrevivan y restauren la función alterada.
Se basa en la capacidad de regeneración hepática. Es una opción terapéutica reversible, menos invasiva que el trasplante de hígado, pero de la que se tiene poca experiencia. Podría servir como puente al trasplante hepático cuando se disponga de órgano.
Es un procedimiento seguro a corto plazo (los estudios hasta el momento actual son limitados y tienen períodos se seguimiento de 2-3 años), pero solo corrige parcialmente el defecto metabólico.
Se realiza mediante Terapia celular hepática, con el aislamiento de hepatocitos del donante, preparación de la suspensión para infusión, criopreservación (por frio) e implantación de los hepatocitos en el receptor mediante el sistema portal. Se sabe que la viabilidad de las células hepáticas es limitada y es posible que se necesite más de una infusión. Requiere además tratamiento inmunosupresor.
Equipo Guía Metabólica. Revisado por las Dras. Angels García (Servicio de Neuropediatría), Cristina Molero y Silvia Meavilla (Sección Gastroenterología, Hepatología y Nutrición), Unidad de Enfermedades Metabólicas del Hospital Sant Joan de Déu.
- 6868 lecturas