Triheptanoína: su uso en el tratamiento de enfermedades metabólicas hereditarias
Resumen de la Cápsula metabólica presentada por Dolores García Arenas en la Unidad de Enfermedades Metabólicas, Hospital Sant Joan de Déu Barcelona el 19 de febrero de 2021.

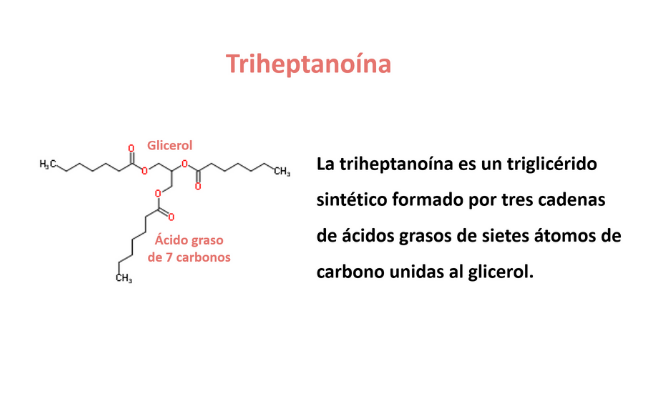
La triheptanoína es un triglicérido sintético formado por tres cadenas de ácidos grasos de siete átomos de carbono unidas al glicerol. Se sintetiza a partir del aceite de ricino y ha sido usado originalmente en la industria humana de la alimentación como aditivo insaboro a los productos lácticos o como emoliente en cosmética.
Se ha aprobado su uso recientemente por la Food and Drug Administration (FDA de EE.UU. en agosto de 2020) para el tratamiento de defectos de la oxidación de ácidos grasos de cadena larga (LC-FAOD). Su aprobación en Europa aún está pendiente.
¿Cómo se metaboliza la triheptanoína?
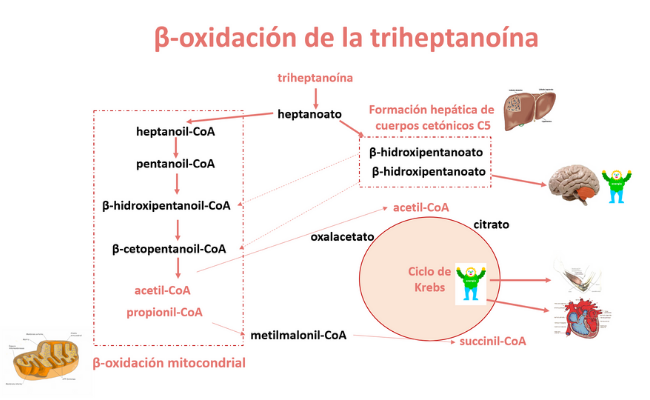
Tras la degradación de la triheptanoína por las lipasas intestinales, el heptanoato (C7) es absorbido en el tracto gastrointestinal y metabolizado principalmente en el hígado.
El heptanoato puede cruzar la membrana mitocondrial sin necesidad de un sistema activo de transporte y entra en la β-oxidación dando dos acetil-CoA y un propionil-CoA. Este se carboxila a metilmalonil-CoA, que pasa a succinil-CoA, un sustrato anaplerótico (de relleno) del ciclo de Krebs y sustrato del complejo II de la cadena respiratoria, con lo que mejora la producción mitocondrial de energía.
Alternativamente, el heptanoato puede experimentar en el hígado un solo ciclo de la β-oxidación y dar lugar a cuerpos cetónicos-C5 (β-cetopentanoato y el β-hidroxipentanoato). Estos, liberados a la circulación, pueden cruzar la barrera hematoencefálica y constituyen un sustrato para la producción de energía cerebral en ausencia de suficiente glucosa.
¿Cuál es el uso de la triheptanoína?
En los últimos 15 años, el uso de la triheptanoína en el tratamiento de diversas enfermedades ha crecido considerablemente. Por su rápido metabolismo y su potencial anaplerótico del Ciclo de Krebs, se ha propuesto su uso en el tratamiento de diversas enfermedades en las que la mejora del metabolismo energético puede mejorar el curso de la enfermedad.
Particularmente las enfermedades neurológicas debidas a la alteración del metabolismo de la glucosa o los defectos de la β-oxidación de los ácidos grasos de cadena larga (LCFAOD) se pueden beneficiar especialmente de las fuentes alternativas de sustrato ofrecidas por los metabolitos derivados de la triheptanoína.
Epilepsias debidas al defecto del transportador GLUT1, así como enfermedades debidas a la disregulación del señalamiento neuronal se han tratado con suplementos de triheptanoína.
Recientes estudios han mostrado que la suplementación con triheptanoína tiene un efecto similar a la dieta cetogénica, incluso en presencia de suficientes niveles de carbohidratos, debido a su efecto anaplerótico.
Defectos de la β-oxidación de los ácidos grasos de cadena larga (LCFAOD)
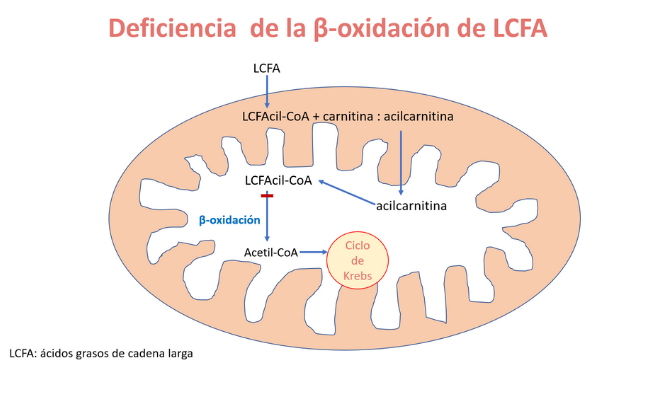
Están causados por la deficiencia de una de las enzimas implicadas en la β-oxidación mitocondrial de los ácidos grasos de cadena larga (LCFAOD), que tienen una longitud de 14 a 20 átomos de carbono.
Esto causa un bloqueo de la β-oxidación con la acumulación de metabolitos de los LCFA potencialmente tóxicos y un defecto de síntesis de acetil-CoA, metabolito clave para la producción de energía por el ciclo de Krebs y la cadena de transporte electrónico.
¿Qué manifestaciones clínicas tiene la deficiencia de LCFA?
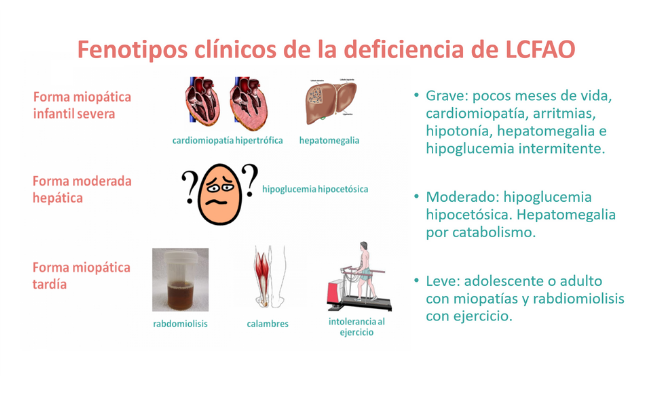
Aun cuando la presentación clínica muestra un espectro continuo, se distinguen tres fenotipos: grave, moderado y leve.
¿Cuál es el tratamiento clásico de la deficiencia de LCFAO?
Las estrategias de tratamiento se basan en prevenir los episodios catabólicos proporcionando suficiente energía, evitando el ayuno excesivo, especialmente durante la enfermedad, y modificando la composición de grasas de la dieta.
La terapia nutricional se debe adaptar a la gravedad del trastorno, pero generalmente incluye restringir la ingesta de ácidos grasos de cadena larga (LCFA) y complementar con triglicéridos de cadena media (MCT).
El MCT está formado por una mezcla de triglicéridos de cadena media, de 6-14 átomos de carbono y se elabora a partir de los aceites de coco y palma, o sea que tiene un origen natural.
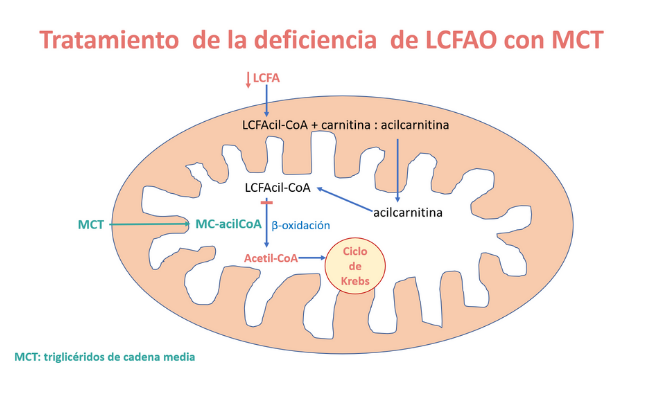
Uso de la triheptanoína en la deficiencia de LCFAO
El uso de triheptanoína en la LCFAOD se basa en la hipótesis de que el defecto de energía puede exacerbarse por la deficiencia de intermediarios del ciclo de Krebs y que se beneficiaría del efecto anaplerótico de la triheptanoína.
Se han realizado en los últimos años diversos estudios en grupos de pacientes con LCFAOD que enfocan diferentes aspectos de estas enfermedades (ver referencias). Se ha demostrado que la triheptanoína mejora tres de los mayores síntomas de LCFAOD: la hipoglicemia, la cardiomiopatía y la rabdomiólisis. Mejora el fenotipo muscular, reduciendo los episodios de rabdomiólisis y las hospitalizaciones.
La triheptanoína en el defecto del transportador de glucosa GLUT1
La deficiencia de GLUT1 es un trastorno autosómico dominante causado por mutaciones en el gen SLC2A1 que codifica para el transportador cerebral de glucosa a través de la barrera hematoencefálica. El defecto de GLUT1 reduce la producción de energía a partir de la glucosa en las células cerebrales, afectando el desarrollo celular y la función cerebral.
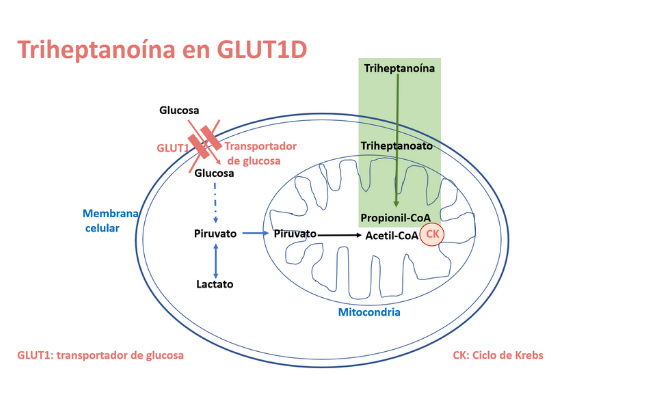
La triheptanoína en la epilepsia y otras enfermedades neurológicas
En el cerebro epiléptico, los intermediarios del ciclo de Krebs pueden estar deficientes, causando hiperexcitabilidad. La triheptanoína puede servir de fuente alternativa de energía.
Se ha postulado en otras enfermedades neurológicas, como el síndrome de Rett, la esclerosis lateral amiotrófica, la enfermedad de Alzheimer, la enfermedad de Huntington, la enfermedad de Canavan, etc.
Efectos secundarios de la triheptanoína
Los efectos secundarios más comunes notificados en algunos pacientes que reciben triheptanoína son: dolor de estómago que incluye malestar estomacal e hinchazón, diarrea (heces blandas, líquidas o acuosas). Otros efectos secundarios menos frecuentes son vómitos y nauseas.
Conclusiones
La triheptanoína puede actuar de agente anaplerótico suministrando acetil-CoA y propionil-CoA y mejorar la producción de energía en algunas enfermedades metabólicas, como los LCFAOD y GLUT1D, así como en la epilepsia y otras enfermedades neurológicas, como el síndrome de Rett o el de Canavan.
Referencias
- Shirley M. Triheptanoin: First Approval. Drugs. 2020 Oct;80(15):1595-1600. Erratum in: Drugs. 2020 Nov;80(17):1873.
- Wehbe Z, Tucci S. Therapeutic potential of triheptanoin in metabolic and neurodegenerative diseases. J Inherit Metab Dis. 2020 May;43(3):385-391.
- Mochel F. Triheptanoin for the treatment of brain energy deficit: A 14-year experience. J Neurosci Res. 2017 Nov;95(11):2236-2243.
- Gillingham MB, Heitner SB, Martin J, Rose S, Goldstein A, El-Gharbawy AH, Deward S, Lasarev MR, Pollaro J, DeLany JP, Burchill LJ, Goodpaster B, Shoemaker J, Matern D, Harding CO, Vockley J. Triheptanoin versus trioctanoin for long-chain fatty acid oxidation disorders: a double blinded, randomized controlled trial. J Inherit Metab Dis. 2017 Nov;40(6):831-843.
- Vockley J, Burton B, Berry G, Longo N, Phillips J, Sanchez-Valle A, Chapman K, Tanpaiboon P, Grunewald S, Murphy E, Lu X, Cataldo J. Effects of triheptanoin (UX007) in patients with long-chain fatty acid oxidation disorders: Results from an open-label, long-term extension study. J Inherit Metab Dis. 2021 Jan;44(1):253-263.
Más información en Guía Metabólica
- 3140 lecturas



