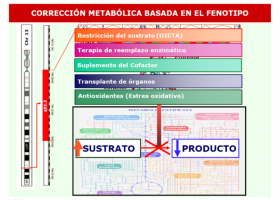
Opciones terapéuticas actuales IV/V: Terapia de inhibición de la síntesis de sustrato (01/2013)
En algunas enfermedades metabólicas (ECM) la alteración y su efecto patogénico se producen por acúmulo de un compuesto (o sustrato) que no se puede metabolizar correctamente.
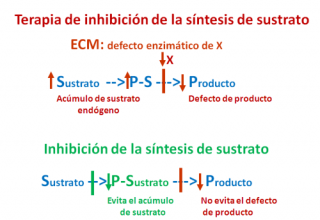
La terapia de inhibición de sustrato se basa en limitar la síntesis endógena (en el interior del organismo) de este compuesto, que es el sustrato de una reacción metabólica de degradación, que no puede llevarse a cabo correctamente debido a un defecto enzimático.
Esta inhibición de la síntesis del sustrato evita su acumulación, que es causa de enfermedad.
¿La acumulación de un sustrato de una reacción metabólica tiene siempre efectos nocivos?
La acumulación de un sustrato causa un desequilibrio de la homeostasis metabólica, que puede tener efectos nocivos. No obstante, dichos efectos dependen de las características del compuesto acumulado.
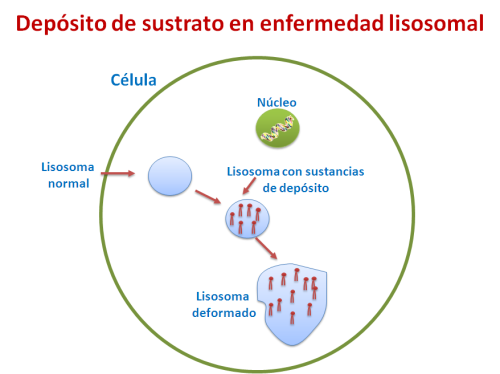
A) Cuando se trata de una molécula compleja (grande), generalmente ésta no puede degradarse (romperse) por un defecto de una enzima lisosomal que interrumpe la vía catabólica (de degradación).
El lisosoma es una estructura u organela celular cuya función principal es la degradación de sustancias. El depósito de grandes moléculas en el lisosoma altera progresivamente su morfología (forma, estructura) y a largo plazo también la función de toda la célula.
Se produce una acción directa de la acumulación del sustrato, que causa un fallo progresivo de todo el sistema lisosomal, una hiperactividad de las moléculas acumuladas y una alteración de la función debido a fallo de síntesis de los productos no formados a causa del defecto enzimático.
Además existen efectos secundarios, causados por la reacción celular a esta acumulación de sustrato, que pueden traducirse en reacciones inflamatorias, alteraciones autoinmunes, anomalías de los sistemas de apoptosis (muerte celular programada), etc…
B) Si se trata de moléculas simples, la acumulación de las mismas puede tener un efecto tóxico, que cause la inhibición secundaria (interferencia o bloqueo) de otras vías metabólicas.
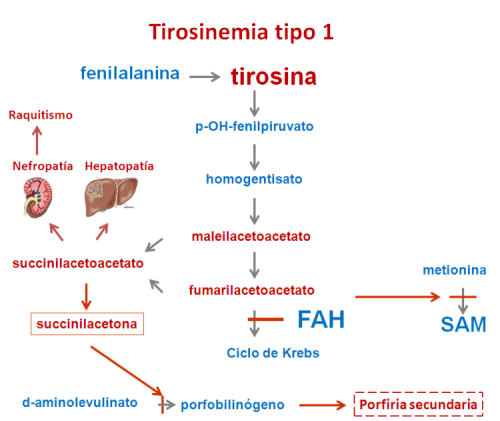
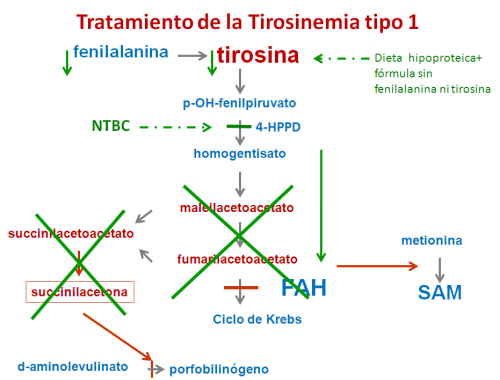
Por ejemplo, en la tirosinemia tipo I, la acumulación de maleilacetoacetato y fumarilacetoacetato y sus derivados: succinil-acetoacetato y succinilacetona tiene un efecto tóxico sobre el hígado y el riñón, que se traduce en una hepatopatía (enfermedad del hígado) grave y en una tubulopatía (afectación del túbulo renal), que deriva en un raquitismo.
Estos metabolitos tóxicos inhiben además otras vías:
- La vía de las porfirinas (una compleja e importante vía metabólica), causando los síntomas neurológicos de porfiria que acompañan a las formas crónicas de Tirosinemia tipo I.
- El metabolismo de los aminoácidos sulfurados (que contienen azufre), causando hipermetioninemia y un defecto de S-adenosilmetionina, compuesto de gran importancia metabólica.
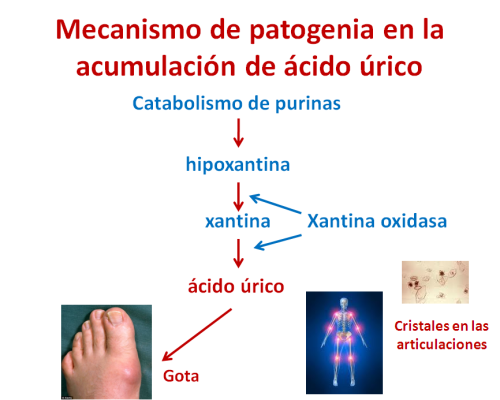
A veces, los metabolitos acumulados causan un proceso inflamatorio, como el causado por la acumulación dentro de las articulaciones de cristales de urato en la gota, etc.
¿Cuál es el efecto de la terapia de inhibición enzimática en las enfermedades lisosomales?
El tratamiento inhibe parcialmente la síntesis del sustrato acumulado debido al defecto enzimático. Esto ocurre porque, si la cantidad de sustrato no es excesiva, con una cierta actividad residual de la enzima deficiente es suficiente para evitar la acumulación patológica del sustrato.
Dicho tratamiento se combina a veces con la terapia de sustitución enzimática para mejorar la efectividad del mismo.
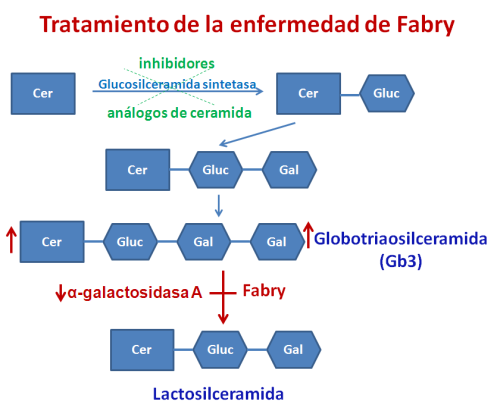
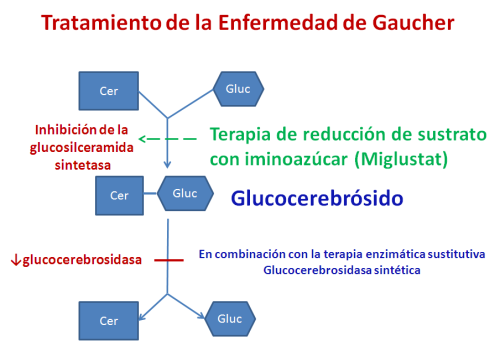
Para inhibir la síntesis de glicoesfingolípidos lisosomales se han descrito dos tipos de fármacos, capaces de inhibir la glicosilceramida sintetasa: los análogos de la ceramida, que son eficaces en disminuir los acúmulos de globotriaosilceramida en la Enfermedad de Fabry.
El segundo tipo está constituido por iminoazúcares, como el NB-DNJ (Miglustat) capaces de inhibir la glucosilceramida sintetasa. Este tratamiento está aprobado en la enfermedad de Gaucher y se está ensayando en las gangliosidosis y en la Enfermedad de Niemann-Pick C.
¿Qué ventaja presenta este tipo de tratamiento en las enfermedades lisosomales?
En relación con la terapia de sustitución enzimática presenta las ventajas de su administración por vía oral, su capacidad para atravesar la barrera hematoencefálica (ya que se trata de moléculas simples, no de proteínas enzimáticas terapéuticas de gran tamaño) y la posibilidad de tratar más de una enfermedad con un mismo fármaco. En cambio, pueden tener efectos secundarios adversos, por lo que su administración debe estar estrictamente controlada por el equipo médico especializado en dichas enfermedades.
¿Qué efecto causa la terapia de inhibición enzimática en las enfermedades del metabolismo intermediario (moléculas simples)?
La inhibición de una vía metabólica en una etapa anterior a la síntesis del producto tóxico acumulado por la deficiencia enzimática causante del ECM evita la acumulación de los metabolitos tóxicos que desencadenan la intoxicación del paciente.
Por ejemplo, en la Tirosinemia tipo I, la administración oral de NTBC (compuesto con actividad herbicida) inhibe la p-hidroxi-fenil-piruvato dioxigenasa (4-HPPD), limitando así la síntesis de homogentisato (sin aparentes consecuencias patológicas) y sus derivados tóxicos, especialmente succinilacetoacetato y succinilacetona.
Esto evita la hepatopatía, tubulopatía y la inhibición de vías secundarias (de las porfirinas y de la metionina) causadas por estos productos tóxicos acumulados.
La administración de una dieta hipoproteica y una fórmula especial con bajo contenido en tirosina y fenilalanina previenen la acumulación de ambos aminoácidos secundaria a la inhibición de su vía catabólica.
El tratamiento con NTBC constituye una excelente alternativa terapéutica al trasplante hepático, única terapia existente anteriormente en esta enfermedad.
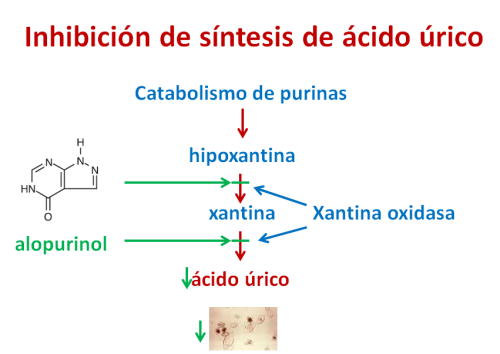
En el caso de la acumulación del ácido úrico causada por alteraciones del catabolismo de las purinas, la inhibición de la xantina oxidasa (enzima del metabolismo de la hipoxantina y xantina) mediante la administración de alopurinol, limita la formación de ácido úrico y su consiguiente depósito en forma de cristales en las articulaciones.
Equipo Guía Metabólica. Revisado por la Dra. Mª Josep Coll, Institut de Bioquímica Clínica, Hospital Clínic, Barcelona.
- 6953 lecturas