Pauta de consenso para el diagnóstico y tratamiento de la deficiencia de la descarboxilasa de los L-aminoácidos aromáticos (AADC)
Artículo: Wassenberg T, Molero-Luis M, Jeltsch K, Hoffmann GF, Assmann B, Blau N, Garcia-Cazorla A, Artuch R, Pons R, Pearson TS, Leuzzi V, Mastrangelo M, Pearl PL, Lee WT, Kurian MA, Heales S, Flint L, Verbeek M, Willemsen M, Opladen T. Consensus guideline for the diagnosis and treatment of aromatic l-amino acid decarboxylase (AADC) deficiency. Orphanet J Rare Dis. 2017 Jan 18;12(1):12. doi: 10.1186/s13023-016-0522-z. PMID: 28100251; PMCID: PMC5241937.

La deficiencia de la descarboxilasa de aminoácidos aromáticos (AADCD) es una enfermedad neurometabólica minoritaria de herencia autosómica recesiva que causa un defecto grave de dopamina, serotonina, epinefrina y norepinefrina. El inicio de la enfermedad es precoz, y sus síntomas principales incluyen hipotonía, trastornos del movimiento (crisis oculógiras, distonía e hipocinesia), retraso del desarrollo y signos disautonómicos.
En esta guía de consenso han participado representantes del Grupo de Trabajo Internacional sobre Trastornos de la Neurotransmisión (iNTD) y representantes de las asociaciones de pacientes, que han evaluado todas las evidencias existentes en relación con el diagnóstico y tratamiento de la AADCD. Las recomendaciones se han realizado siguiendo la metodología SIGN y GRADE.
A pesar de los bajos niveles de evidencia existentes, se han podido establecer recomendaciones prácticas y que pueden ser muy útiles sobre el diagnóstico clínico y de laboratorio, las pruebas de neuroimagen y electroencefalográficas y sobre tratamientos tanto médicos como de soporte. Se han identificado además temas que pueden ser interesantes para desarrollar en el campo de la investigación de la AADCD.
Como conclusión, pensamos que esta guía aumentará la calidad en los cuidados de los pacientes con AADCD en todo el mundo, y que aumentará el conocimiento de esta rara enfermedad.
¿Qué es la deficiencia de la descarboxilasa de los L-aminoácidos aromáticos (AADC)?
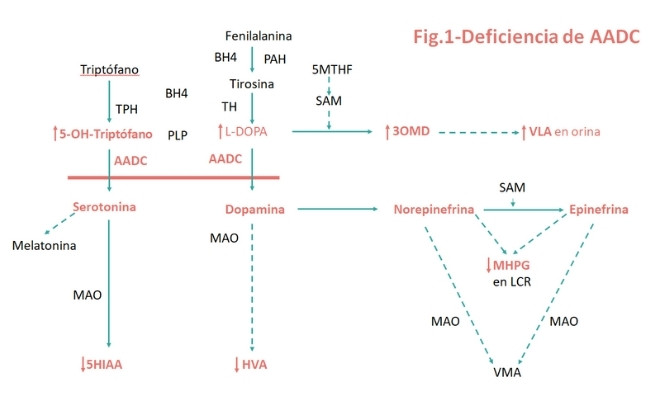
La descarboxilasa de los L-aminoácidos aromáticos (AADC; EC 4.1.1.28) es la enzima final en la biosíntesis de los neurotransmisores monoaminados, serotonina y dopamina, siendo la dopamina el precursor de la norepinefrina y epinefrina. La deficiencia de AADC (AADCD; OMIM 608643) es un trastorno neurometabólico minoritario, de herencia autosómica recesiva, que conduce a una deficiencia combinada grave de serotonina, dopamina, norepinefrina y epinefrina (figura 1).
Desde la descripción inicial de la familia índice en 1990, se han descrito más de 100 pacientes con AADCD, aunque la incidencia mundial se desconoce. No existen programas de detección de recién nacidos, pero es más frecuente en ciertos países asiáticos.
Para mejorar la atención de los pacientes con trastornos relacionados con los neurotransmisores (incluida la AADCD), se fundó en 2013 el Grupo de Trabajo Internacional sobre Trastornos Relacionados con Neurotransmisores (iNTD).
Actualmente, el iNTD es una red mundial en crecimiento que incluye 38 centros neurometabólicos de 24 países. Además de mantener un registro de pacientes, uno de sus objetivos es desarrollar pautas de atención consensuadas para trastornos relacionados con neurotransmisores, agrupando toda la evidencia publicada y la experiencia de los principales centros de expertos.
Temas a tratar
Los temas desarrollados son: (I) Presentación Clínica de AADCD; (IIa) Diagnóstico: pruebas de laboratorio; (IIb) Diagnóstico: imagen; (III) Tratamiento; (IV) Complicaciones y Manejo a largo plazo; (V) Asuntos Sociales y Transición al adulto; y (VI) Situaciones especiales.
Grado de evidencia y recomendaciones
La guía se desarrolló de acuerdo con SIGN (Scottish Intercollegiate Guideline Network). Para calificar la calidad de la evidencia y definir la fuerza de las recomendaciones, SIGN utiliza la Metodología GRADE. El nivel de evidencia de los estudios individuales se calificó en un rango de 4 (el más bajo: opinión del experto) a 1++ (el más alto: metaanálisis de alta calidad).
Parte I: Presentación clínica
Número de pacientes
Para los cálculos de las características de los pacientes se han utilizado 117 de los 139 pacientes con AADCD descritos. Muchos pacientes (50/117) son asiáticos, ya que hay una mayor prevalencia de AADCD en pacientes de ascendencia del sur de China, especialmente de Taiwán y Japón, debido a la variante fundadora IVS6 +4A > T.
- Recomendación #1 (fuerte): Debería haber una mayor concienciación de AADCD en pacientes de ascendencia china/taiwanesa/japonesa, debido a la presencia de una variante fundadora (IVS6 + 4A > T).
Edad de inicio y edad de diagnóstico
La edad de inicio de los signos y síntomas está claramente documentada solo en 68 casos, y ocurre dentro del primer año de vida (media: 2,7 meses, DE ± 2,7). A pesar de la aparición temprana de los síntomas, la edad media de diagnóstico fue de 3,5 años (mediana 13 meses, rango 2 meses – 23 años).
Síntomas y signos clave
Los síntomas clave de AADCD son: hipotonía (n= 91/117 pacientes), trastornos del movimiento (n = 99/117), retraso en el desarrollo (n = 84/117), y síntomas autonómicos (n = 76/117). Todos los síntomas clave varían de leve a muy grave. Los trastornos del movimiento más frecuentes son crisis oculógiras (n = 91), distonía (n = 63) e hipocinesia (n = 40). Los signos autonómicos más prominentes son ptosis, sudoración excesiva y congestión nasal.
- Recomendación #2 (fuerte): En niños con hipotonía inexplicable, trastornos del movimiento (especialmente crisis oculógiras), retraso en el desarrollo y síntomas autonómicos, se debe considerar una AADCD.
Otros hallazgos neurológicos
Se describieron crisis epilépticas en 9 pacientes. Los problemas de comportamiento estaban presentes en 41 casos (irritabilidad, llanto excesivo, disforia y rasgos autistas). Los trastornos del sueño (tanto el insomnio como la hipersomnia) se han descrito en 34 pacientes.
- Recomendación #3 (investigación): Los síntomas conductuales y los trastornos del sueño en el AADCD deben definirse mejor para mejorar la atención al paciente.
Hallazgos clínicos adicionales
Los problemas gastrointestinales pueden ser prominentes en AADCD (diarrea, estreñimiento, reflujo gastroesofágico y dificultades para alimentarse). Muchos pacientes pueden beneficiarse de una gastrostomía. A menudo se informa retraso en el desarrollo y baja estatura. En 13 pacientes se describió una hipoglucemia intermitente al nacer o en los primeros cinco años de vida.
Espectro fenotípico y curso clínico
- Recomendación #4 (condicional): El espectro fenotípico de AADCD es amplio y puede variar de muy grave a relativamente leve. También se debe considerar el AADCD en pacientes con síntomas autonómicos sin trastornos del movimiento evidentes.
- Recomendación #5 (fuerte): No se espera un curso clínico de deterioro en pacientes con AADCD y éste debe conducir al diagnóstico de otras enfermedades.
Correlaciones fenotipo-genotipo o con el fenotipo bioquímico
- Recomendación #6 (condicional): No hay correlaciones claras de genotipo/fenotipo bioquímico o fenotipo clínico en AADCD, excepto para la variante homocigota IVS6 + 4A > T, que está asociada con un fenotipo grave en todos los casos descritos. También en variantes raras del sitio de unión de L-Dopa, que están asociados con la capacidad de respuesta a L-Dopa.
Parte IIa: Diagnóstico, pruebas de laboratorio
Pruebas diagnósticas clave: LCR, actividad AADC y pruebas genéticas
- Recomendación #7 (fuerte): La AADCD se puede diagnosticar en LCR. Las mediciones específicas en LCR deben incluir los metabolitos centrales HVA, 5-HIAA, 3-OMD, L-Dopa, 5-HTP y pterinas. Si es posible, también deben medirse 5-MTHF y PLP. Una reducción de 5-HIAA y HVA, y elevación de 3-OMD, L-Dopa y 5-HTP, con pterinas normales, orientan hacia la AADCD.
- Recomendación #8 (buena práctica): Las determinaciones en el LCR siempre deben incluir mediciones estándar (células, proteína, glucosa, lactato). La recogida y manipulación del LCR debe realizarse siguiendo estrictamente los procedimientos estandarizados para asegurar la correcta interpretación de los resultados.
Actividad de AADC en plasma
- Recomendación #9 (fuerte): La AADCD se puede diagnosticar demostrando una actividad de AADC muy disminuida en plasma. La actividad de AADC en plasma se halla moderadamente reducida en portadores heterocigotos.
Diagnóstico molecular
- Recomendación #10 (fuerte): En la gran mayoría de los pacientes, la AADCD se puede confirmar genéticamente.
Conclusiones sobre las pruebas clave de diagnóstico
- Recomendación #11 (fuerte): Hay tres claves básicas de diagnóstico para identificar AADCD:
- (1) En LCR: niveles bajos de 5-HIAA, HVA y MHPG, niveles elevados de 3-OMD, L-Dopa y 5-HTP, y pterinas normales.
- (2) variantes patogénicas en el gen DDC en forma de heterocigotos combinados u homocigotos.
- (3) disminución de la actividad de la enzima AADC en plasma.
- Para diagnosticar AADCD, se deben realizar pruebas genéticas y al menos dos de los tres pruebas diagnósticas básicas deben ser positivas.
- Recomendación #12 (fuerte): Si el diagnóstico genético se realiza como primer paso (por ejemplo, secuenciación del exoma completo o un miembro de la familia afectado), la confirmación funcional debe completarse midiendo la actividad de la enzima AADC en plasma y/o metabolitos de neurotransmisores en LCR.
- Recomendación #13 (condicional): Si los recursos locales lo permiten, recomendamos realizar las tres pruebas diagnósticas clave en pacientes con este raro trastorno.
- Recomendación #14 (buena práctica): Los resultados del análisis de LCR y la medición de la actividad de AADC en plasma generalmente están disponibles antes de los resultados de las pruebas genéticas. No debe esperarse la confirmación genética para iniciar la terapia.
Otras pruebas diagnósticas en AADCD
Prolactina
La prolactina en sangre puede aumentar en los trastornos de la biosíntesis de dopamina, porque la dopamina actúa como inhibidor de la secreción de prolactina.
- Recomendación #15 (investigación): El nivel normal de prolactina en la sangre no excluye AADCD. Para comprender mejor este mecanismo, recomendamos más investigación sobre este tema.
Metabolitos de neurotransmisores en sangre
- Recomendación #16 (fuerte): La medición de metabolitos de catecolaminas en sangre no es útil en la práctica clínica, porque no diagnostica ni excluye AADCD.
Valoración de 3-OMD en sangre seca
- Recomendación #17 (investigación): El desarrollo, la precisión diagnóstica y la rentabilidad de la valoración de 3-OMD para la detección neonatal de AADCD se debe investigar más.
Determinación en orina de metabolitos de neurotransmisores
- Recomendación #18 (condicional): Si se detecta un aumento del VLA urinario, se debe considerar AADCD. Sin embargo, los niveles normales de VLA no excluyen el diagnóstico.
- Recomendación #19 (fuerte): La medición de metabolitos de catecolaminas en la orina no es útil como prueba de diagnóstico en la práctica clínica, porque no puede ni diagnosticar ni excluir AADCD.
Otras pruebas diagnósticas
- Recomendación #20 (investigación): Otras pruebas diagnósticas que podrían aumentar el conocimiento sobre AADCD y/o servir como posibles biomarcadores son la melatonina y la amplia detección metabolómica de marcadores específicos relacionados con AADCD.
Parte IIb: Diagnóstico por la imagen y electroencefalografía
Imágenes por resonancia magnética (IRM) del cerebro
- Recomendación #21 (condicional): Las imágenes de rutina del cerebro no son necesarias para diagnosticar AADCD.
- Recomendación #22 (buena práctica): En el estudio de pacientes con retraso en el desarrollo neurológico y en caso de desviación inesperada del curso clínico en pacientes con AADCD, se deben considerar las imágenes cerebrales.
Electroencefalografía (EEG)
- Recomendación #23 (condicional): El EEG no es necesario para diagnosticar un AADCD.
- Recomendación #24 (buena práctica): El EEG se puede utilizar en el tratamiento de AADCD si hay sospecha clínica de epilepsia, para diferenciar crisis oculógiras de eventos epilépticos, o en el estudio general del retraso del neurodesarrollo.
Otras modalidades de imagen
- Recomendación #25 (investigación): Otras modalidades de imagen (FDG PET, FDOPA PET, DAT-scan) no tienen ningún papel en la rutina clínica, pero pueden ser útiles en entornos de investigación, p. ej. la evaluación de la eficacia de la terapia génica.
Parte III: Tratamiento
IIIa: Tratamiento farmacológico
Tratamiento de primera línea
Agonistas de la dopamina
Los agonistas de dopamina activan directamente los receptores de dopamina postsinápticos.
- Recomendación #26 (fuerte): Los agonistas de la dopamina deben probarse en el tratamiento de la AADCD. Son preferibles los agonistas de la dopamina no derivados del cornezuelo de centeno (pramipexol, ropinirol, rotigotina).
- Recomendación #27 (fuerte): La cabergolina y la pergolida no deben utilizarse para el tratamiento de AADCD debido al elevado riesgo de complicaciones fibróticas.
- Recomendación #28 (buena práctica): Están indicadas las exploraciones cardíacas (ver R#48) antes y durante el tratamiento con bromocriptina (agonista dopaminérgico derivado del cornezuelo de centeno), debido al potencial riesgo de fibrosis cardiaca.
Inhibidores de la MAO
Los inhibidores de la MAO previenen la degradación de la dopamina y serotonina, lo que aumenta la disponibilidad de monoaminas.
- Recomendación #29 (fuerte): Desde el punto de vista bioquímico es muy recomendable hacer a los pacientes con AADCD un ensayo de inhibidores de la MAO, aunque hay poca evidencia de beneficio clínico.
Piridoxina / fosfato de piridoxal (PLP)
El fosfato de piridoxal (PLP), la forma activa de la piridoxina, es un cofactor de AADC (figura 1). Por lo tanto, el tratamiento con una de varias formas disponibles de vitamina B6 podría aumentar la actividad residual de la enzima AADC.
- Recomendación #30 (fuerte): La vitamina B6 se considera un tratamiento de primera línea desde un punto de vista bioquímico, pero debe respetarse los límites de dosis debido a los posibles efectos secundarios.
- Recomendación #31 (condicional): Es preferible la piridoxina al PLP debido a la disponibilidad y el menor coste. Si no se tolera, en su lugar, se puede probar el PLP.
Tratamiento sintomático adicional
Fármacos anticolinérgicos
Los fármacos anticolinérgicos (p. ej., trihexifenidilo, pino benztropina, biperideno) se utilizan comúnmente para tratar ciertos trastornos del movimiento, especialmente parkinsonismo y distonía. Aunque su mecanismo exacto de acción no se conoce, se cree que influyen en el desequilibrio relativo entre las vías dopaminérgicas y vías colinérgicas.
- Recomendación #32 (condicional): Los agentes anticolinérgicos pueden ser considerados en AADCD, especialmente (adicionalmente) para tratar los síntomas autonómicos, distonía y crisis oculógiras.
Melatonina
Hay evidencia muy limitada para el uso de melatonina en AADDC.
- Recomendación #33 (condicional): Se debe considerar la melatonina para el tratamiento de los trastornos del sueño en AADCD.
Benzodiazepinas
- Recomendación #34 (condicional): Las benzodiazepinas, especialmente cuando se usan de forma intermitente, se pueden considerar en entornos específicos, p.ej. en crisis oculógiras o distónicas sostenidas.
Otros tratamientos sintomáticos
Aunque no hay informes que evalúen específicamente el uso de gotas nasales de alfa-adrenoreceptor en AADCD, su valor es evidente en la práctica clínica para tratar la congestión nasal. La Clonidine, una imidazolina y un agonista alfa-2, puede usarse para la irritabilidad y los trastornos del sueño. Las inyecciones de toxina botulínica pueden utilizarse en el tratamiento de la distonía.
Otras opciones de tratamiento
L-Dopa con o sin carbidopa
Los pacientes con AADCD ya tienen niveles muy elevados de L-Dopa, por lo que el tratamiento con L-Dopa es contradictorio y solo se informó en 10 casos. Sin embargo, en 4 pacientes con variantes que afectan al sitio de unión de L-Dopa, se observó un efecto sostenido de L-Dopa.
- Recomendación #35 (fuerte): L-Dopa es el tratamiento de primera línea solo para pacientes con variantes que afectan el sitio de unión de L-Dopa (por ejemplo, p.[G102S], p.[R347Q], p.[R160W]). En teoría, se prefiere L-Dopa sin carbidopa.
- Recomendación #36 (condicional): En pacientes sin variantes comprobadas del sitio de unión de L-Dopa, se puede considerar una prueba de L-Dopa si fallan otras opciones de tratamiento.
- Recomendación #37 (fuerte): Los niveles de 5-MTHF en LCR deben determinarse antes y durante la terapia con L-Dopa.
Ácido folínico
En teoría, la deficiencia secundaria de folato cerebral puede desarrollarse en AADCD, ya que la O-metilación del exceso de L-Dopa a 3-OMD agotan los donantes de metilo incluyendo SAM y 5-MTHF.
- Recomendación #38 (condicional): Se puede considerar la suplementación con ácido folínico en todos los pacientes y se recomienda claramente cuando el nivel de 5-MTHF en el LCR es bajo.
- Recomendación #39 (investigación): Se requiere más investigación sobre el 5-MTHF para poder hacer recomendaciones firmes sobre la suplementación con ácido folínico y el seguimiento con 5-MTHF en AADCD. En este momento, no recomendamos las punciones lumbares periódicas de seguimiento en pacientes estables. En caso de deterioro clínico inesperado, debe considerarse la valoración de 5-MTHF en LCR para descartar la deficiencia secundaria de folato.
5-Hidroxitriptófano (5-HTP)
- Recomendación #40 (fuerte): Basado en la evidencia actual y en los mecanismos fisiopatológicos, el 5-HTP no debe ser utilizado en el tratamiento de AADCD.
Inhibidores selectivos de la recaptación de serotonina (ISRS)
- Recomendación #41 (condicional): Basado en la evidencia actual, no se recomienda el uso de ISRS en AADCD.
Esquema de tratamiento en la AADCD
En la Tabla 4 del artículo original (ver referencia) se resumen los fármacos y las dosis recomendadas.
- Recomendación #42 (fuerte): Las recomendaciones básicas para el tratamiento en AADCD son:
- Los agentes de tratamiento de primera línea son los agonistas selectivos de la dopamina, inhibidores de la MAO y piridoxina.
- Los agentes de tratamiento sintomático adicionales son anticolinérgicos, melatonina, benzodiazepinas, y bloqueadores alfa-adrenérgicos.
- En general, será necesaria la terapia con múltiples fármacos y las dosis deben administrarse individual y secuencialmente.
- Los principios generales de tratamiento que se deben cumplir son: enfoque gradual, comenzar poco a poco y aumentar lentamente las dosis, y discontinuar/retirar la medicación si ésta no es útil.
- Recomendación #43 (investigación): Dado que la evidencia para el tratamiento en AADCD es de baja a muy baja, sería deseable realizar ensayos clínicos aleatorios en AADCD para mejorar el esquema de tratamiento propuesto.
Fármacos a evitar en AADCD
- Recomendación #44 (fuerte): Los antagonistas dopaminérgicos de acción central se deben evitar en AADCD.
- Recomendación #45 (buena práctica): Los cuidados de soporte en náuseas y vómitos en los pacientes con AADCD deben ser óptimos. Si se requiere tratamiento, se puede considerar una dosis baja de domperidona.
Crisis distónicas
- Recomendación #46 (buena práctica): La crisis distónica en AADCD es potencialmente mortal y debe tratarse de inmediato.
Parte IIIb: Tratamiento no farmacológico
Tratamiento paramédico en AADCD
- Recomendación #47 (buena práctica): La participación de un equipo multidisciplinario que incluya un médico rehabilitador (fisioterapeuta) y profesionales de la salud aliados (servicios de terapia paramédica) es esencial en el cuidado de los pacientes con AADCD.
Terapia génica y otras opciones de tratamiento quirúrgico
- Recomendación #48 (investigación): La terapia génica para AADCD se encuentra actualmente en fase de investigación. Los resultados del ensayo clínico determinarán si en el futuro se puede implementar esta prometedora terapia.
Parte IV: Complicaciones y manejo a largo plazo en AADCD
Descompensación cardíaca
- Recomendación #49 (fuerte): Se debe concienciar de posibles complicaciones cardíacas en pacientes con AADCD durante situaciones potencialmente estresantes y se recomienda el monitoreo cardíaco en estos casos. No es necesario un examen de seguimiento cardíaco regular, pero se recomienda antes de cualquier anestesia o intervención. Si está disponible en el entorno local, el examen cardíaco debe consistir en una derivación a un cardiólogo (pediátrico) para evaluación clínica, ECG y ecocardiograma.
Complicaciones ortopédicas
- Recomendación #50 (buena práctica): Los pacientes con AADCD deben ser monitoreados para complicaciones ortopédicas siguiendo los estándares de buena atención a los pacientes con discapacidad motora.
Infecciones
- Recomendación #51 (buena práctica): Debido a que los pacientes con AADCD tienen una respuesta reducida al estrés, se recomienda una estrecha vigilancia durante las infecciones.
- Recomendación #52 (buena práctica): Las vacunas según los programas de vacunación local se recomiendan en AADCD.
Visitas de seguimiento
- Recomendación #53 (fuerte): Los pacientes con AADCD deben ser atendidos al menos anualmente por un neurólogo (infantil) con experiencia en trastornos del movimiento o enfermedades neurometabólicas, idealmente en un entorno multidisciplinario (ver R#46), que facilita un enfoque de atención total.
Tarjeta de urgencia
- Recomendación #54 (buena práctica): Se recomienda que todos los pacientes con AADCD reciban una tarjeta de urgencia, que incluya información breve sobre AADCD, posibles complicaciones y medicamentos a evitar en este trastorno.
Parte V: Problemas sociales y transición
Apoyo psicológico a las familias
- Recomendación #55 (fuerte): Si está disponible en el entorno de atención local, se recomienda el apoyo psicológico (p. ej., psicólogo, trabajador social) para cuidadores, hermanos y pacientes con AADCD.
- Recomendación #56 (investigación): Se necesita investigación adicional para conocer si los portadores de la variante del gen tienen un mayor riesgo primario (determinado genéticamente) de trastornos psiquiátricos.
Consejo genético
- Recomendación #57 (fuerte): Si está disponible en entornos de atención locales, se debe ofrecer a los padres de pacientes con AADCD un asesoramiento genético estándar.
Asociaciones de padres
- Recomendación #58 (fuerte): Se recomienda que los cuidadores de pacientes con deficiencia de AADC sean informados sobre las asociaciones de padres existentes para esta rara enfermedad.
Transición de edad infantil al adulto
- Recomendación #59 (buena práctica): La atención a la transición de niños con AADCD a adultos debe estar bien preparada y continuar llevándose a cabo en centros especializados. Se debe continuar la atención multidisciplinar.
- Recomendación #60 (investigación): Se recomiendan enfáticamente los estudios de seguimiento de pacientes adultos con AADCD para definir mejor el pronóstico y posibles nuevos síntomas y signos clínicos en la adolescencia y la edad adulta.
Parte VI: Situaciones especiales
Anestesia para intervenciones
- Recomendación #61 (fuerte): La anestesia debe estar bien preparada en pacientes con AADCD porque tienen un mayor riesgo de inestabilidad hemodinámica e hipoglucemia. Además del control cardiovascular, se recomiendan el control de la temperatura y los niveles de glucosa durante la intervención. En general, se recomienda continuar con el tratamiento estándar (incluyendo inhibidores de la MAO) durante las intervenciones.
Cuidados Intensivos
- Recomendación #62 (fuerte): La AADCD da lugar a un deterioro simpático con posibles complicaciones cardíacas. Esto debería anticiparse durante las admisiones a la UCI.
Diagnóstico prenatal
- Recomendación #63 (fuerte): Si los recursos locales lo permiten, se debe ofrecer el diagnóstico genético prenatal o las técnicas de preimplantación a los portadores de AADCD.
Conclusiones
AADCD es un trastorno de inicio temprano que causa una deficiencia combinada de serotonina, dopamina, norepinefrina y epinefrina. Los síntomas clínicos clave son hipotonía, trastornos del movimiento (especialmente crisis oculógiras, distonía e hipocinesia), retraso en el desarrollo y síntomas autonómicos. El espectro fenotípico es amplio y puede variar de muy grave a relativamente leve. No hay correlaciones claras genotipo/fenotipo en AADCD excepto para la variante de empalme homocigoto IVS6 + 4A > T que se asocia con un fenotipo grave en todos los casos descritos hasta la fecha, y tiene una mayor incidencia en personas de etnia china.
Existen tres herramientas básicas de diagnóstico para identificar AADCD:
- Niveles bajos en LCR de 5-HIAA, HVA y MHPG, con pterinas normales y niveles elevados de L Dopa, 3-OMD y 5-HTP en el LCR.
- El diagnóstico genético muestra variantes patológicas heterocigotas combinadas o homocigotas en el gen DDC.
- Disminución de la actividad de la enzima AADC en plasma.
Las recomendaciones básicas para el tratamiento del AADCD son:
- Tratamiento de primera línea con agonistas selectivos de dopamina, inhibidores de la MAO y piridoxina;
- Tratamiento sintomático adicional con fármacos anticolinérgicos, melatonina, benzodiazepinas, y bloqueadores de los receptores alfa-adrenérgicos.
- En general, se necesitarán múltiples tipos de medicamentos.
- Los principios generales del tratamiento a los que se debe adherir son: un enfoque gradual, comenzar lentamente e ir despacio al aumentar las dosis, y suspender/retirar gradualmente medicamento que no sea útil.
Es fundamental la participación de un equipo multidisciplinar, que incluya los servicios de fisioterapia y paramédicos en el cuidado de pacientes con AADCD.
Referencia
Wassenberg T, Molero-Luis M, Jeltsch K, Hoffmann GF, Assmann B, Blau N, Garcia-Cazorla A, Artuch R, Pons R, Pearson TS, Leuzzi V, Mastrangelo M, Pearl PL, Lee WT, Kurian MA, Heales S, Flint L, Verbeek M, Willemsen M, Opladen T. Consensus guideline for the diagnosis and treatment of aromatic l-amino acid decarboxylase (AADC) deficiency. Orphanet J Rare Dis. 2017 Jan 18;12(1):12. doi: 10.1186/s13023-016-0522-z. PMID: 28100251; PMCID: PMC5241937.
- 1655 lecturas