Terapias en las enfermedades mitocondriales
Resumen de la Cápsula Metabólica presentada por la Dra. Àngels García-Cazorla, en la Unidad de Enfermedades Metabólicas Congénitas del Hospital Sant Joan de Déu Barcelona, el 5 de marzo de 2021

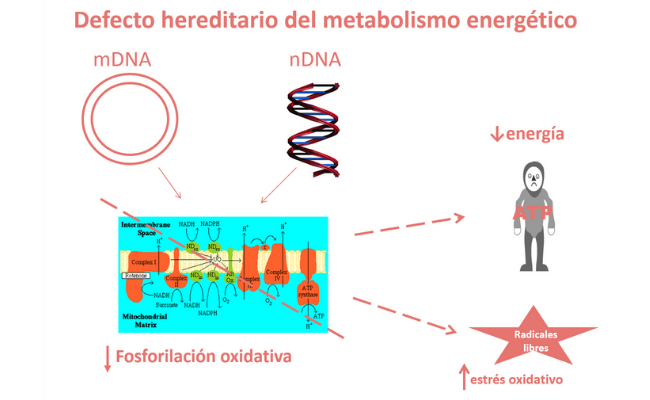
Las enfermedades mitocondriales (EM) son un grupo heterogéneo de trastornos genéticos hereditarios, causados por variantes patogénicas en varios cientos de diferentes genes del ADN nuclear y mitocondrial. Son clínicamente heterogéneas, pudiéndose presentar con una gran cantidad de signos y síntomas que pueden afectar a todos los órganos.
Aunque el origen genético individual de la enfermedad mitocondrial es poco frecuente, las enfermedades mitocondriales afectan colectivamente al menos 1 de cada 4.300 individuos.
¿Cuál es el efecto patofisiológico de las EM?
A pesar de su origen heterogéneo, su efecto patofisiológico es común, e implica una reducción de la producción mitocondrial de energía en forma de adenosín trifosfato (ATP) y un aumento del estrés oxidativo debido al desequilibrio entre la producción excesiva de radicales libres y su eliminación.
¿Cuál es la base del tratamiento de las EM?
El tratamiento de las EM se basa en mejorar la capacidad de fosforilación oxidativa residual de la cadena respiratoria mitocondrial (es decir, la producción mitocondrial de ATP) y reducir el estrés oxidativo. La cadena respiratoria mitocondrial es, en condiciones fisiológicas, la mayor fuente de generación de radicales libres de oxígeno, y se ha demostrado que, en condiciones patológicas, éstos aumentan, siendo uno de los mecanismos fisiopatológicos fundamentales y común a muchas EM.
Aunque existen hoy en día tratamientos curativos, el objetivo clínico de las terapias disponibles es mejorar la actividad enzimática residual de la cadena respiratoria, apoyar vías alternativas de producción de energía y proporcionar resiliencia para satisfacer las necesidades celulares durante tiempos de estrés metabólico suficiente para prevenir la descompensación clínica aguda. En resumen, el objetivo clínico es mitigar los síntomas y prevenir la progresión de la enfermedad.
¿Cómo se consiguen estos objetivos?
Se utiliza una combinación de vitaminas, cofactores y antioxidantes, combinación que puede modificarse (en composición y dosis) en base al origen genético, al fenotipo clínico y a los hallazgos bioquímicos de cada paciente.
¿En qué consiste esta combinación terapéutica?
Comprende un conjunto de vitaminas B, otros cofactores de enzimas mitocondriales, antioxidantes y suplementos nutricionales. Esta combinación de agentes, que tienen mecanismos de acción complementarios, se denomina terapia mitocondrial, e incluye un multivitamínico, uno o más antioxidantes y coenzima Q10.
¿Qué vitaminas se usan en enfermedades mitocondriales?
Las vitaminas B son cofactores de muchas reacciones enzimáticas.
- La tiamina (vitamina B1) es cofactor del complejo piruvato deshidrogenasa.
- La riboflavina (vitamina B2) es un precursor tanto de la flavina mononucleótido (FMN), componente necesario en la biosíntesis del complejo I de la cadena respiratoria, así como de la flavina: adenina dinucleótido (FADH), el equivalente reducido consumido por el complejo II de la cadena respiratoria.
- La niacina (vitamina B3) es un precursor de la nicotinamida: adenina dinucleótido (NADH), que es dador de electrones para el complejo I de la cadena respiratoria. La niacina ayuda a restaurar el equilibrio NADH/NAD+.
- La biotina (vitamina B7) es el cofactor de las carboxilasas mitocondriales, incluida la piruvato carboxilasa.
- El ácido fólico (vitamina B9) es necesario para las reacciones de transferencia de un átomo de carbono; la forma activa, el ácido folínico es capaz de cruzar la barrera hematoencefálica y es especialmente importante en las enfermedades mitocondriales asociadas con deficiencia de folato cerebral.
¿Cuáles son los antioxidantes usados en EM?
Los antioxidantes de uso común que generalmente son bien tolerados incluyen:
- La vitamina E es un potente antioxidante, que actúa principalmente en la membrana mitocondrial y plasmática para eliminar los radicales libres y prevenir el daño oxidativo a los ácidos grasos poliinsaturados en las membranas. Actúa de forma sinérgica con elCoQ10.
- El ácido α-lipoico oxidante intramitocondrial y componente de la enzima piruvato deshidrogenasa.
- El ubiquinol es la forma reducida y más biodisponible de la CoQ10, que juega un papel en el transporte de electrones de los complejos de la cadena respiratoria.
- La idebenona es una versión sintética del CoQ10 que no está aprobada por la FDA (USA), pero si parcialmente por la EMA europea para la neuropatía óptica hereditaria de Leber.
- La N-acetilcisteína es precursor de la síntesis de glutatión, el principal antioxidante endógeno, que a menudo está deficiente en las EM.
- La luteína es un antioxidante producido por las plantas (carotenoide), que es usado en la retinitis pigmentaria.
La vitamina C se ha usado tradicionalmente como antioxidante pero esta función no se ha podido demostrar en la EM.
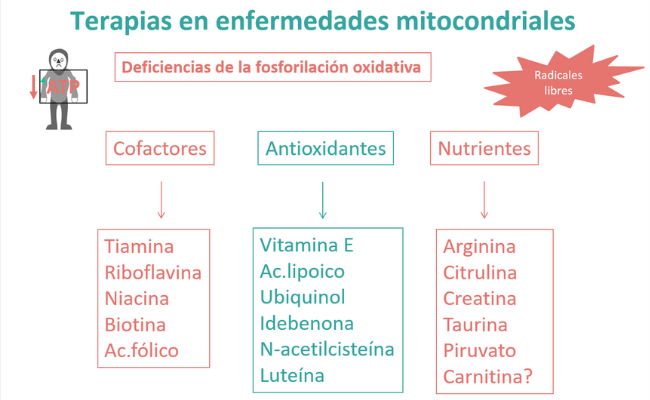
¿Qué otros nutrientes se utilizan como terapias mitocondriales?
- La L-arginina es un sustrato de óxido nítrico sintasa en el endotelio vascular, que se puede administrar para aumentar los niveles del óxido nítrico y relajar el músculo liso vascular. La L arginina se usa para tratar y prevenir los accidentes cerebrovasculares en la enfermedad mitocondrial, con datos recientes que sugieren una mejor supervivencia y una reducción de la debilidad en el síndrome de MELAS y beneficio clínico cuando se administra de forma aguda a pacientes pediátricos con síndrome de Leigh.
- La L-citrulina es un precursor de L-arginina que conduce incluso a una mayor síntesis de óxido nítrico, por tanto, con las mismas indicaciones que la L-arginina.
- La L-creatina es particularmente útil en personas con miopatía mitocondrial que presentan intolerancia al ejercicio y fatiga muscular.
- La taurina demostró eficacia en la reducción de la frecuencia de accidentes vasculares cerebrales en el síndrome de MELAS.
- El piruvato se ha propuesto para mejorar el equilibrio NADH/NAD+, pero no es ampliamente usado.
- La L-carnitina se ha usado tradicionalmente para eliminar metabolitos tóxicos de la mitocondria (ácidos grasos de cadena larga y otros ácidos orgánicos), pero su uso crónico no parece aconsejable ya que se ha asociado a la aterosclerosis.
Conclusiones
- A pesar de la ausencia de ensayos clínicos aleatorios, se han identificado compuestos potencialmente beneficiosos con una alta relación beneficio-riesgo que generalmente son bien tolerados en pacientes con enfermedades mitocondriales.
- Las terapias mitocondriales tienen un mecanismo de acción complementario, como un complejo multivitamínico, uno o más antioxidantes (vitamina E y/o ácido lipoico, así como N-acetilcisteína cuando hay una deficiencia plasmática de glutatión), y la coenzima Q10 son generalmente bien tolerados cuando se administran juntos.
- Las terapias específicas tienen un beneficio particular para algunas etiologías genéticas y/o fenotipos compartidos, como la arginina para accidentes cerebrovasculares metabólicos, el ácido folínico para trastornos de la sustancia blanca, L-creatina para las miopatías metabólicas, dosis alta de N-acetilcisteína para la encefalopatía etilmalónica, biotina y tiamina para la enfermedad de los ganglios basales que responde a la biotina/tiamina y ubiquinol en dosis alta para la deficiencia primaria de CoQ10.
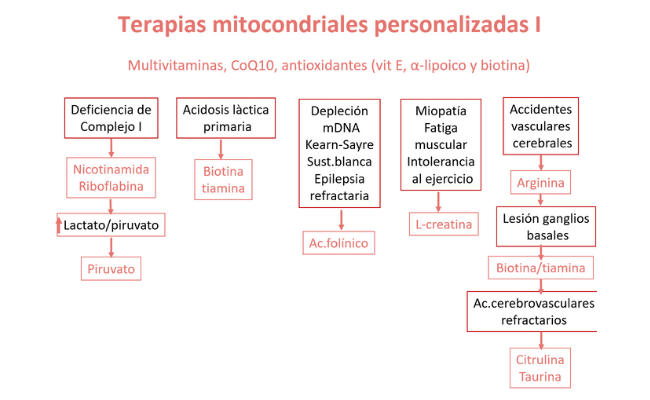
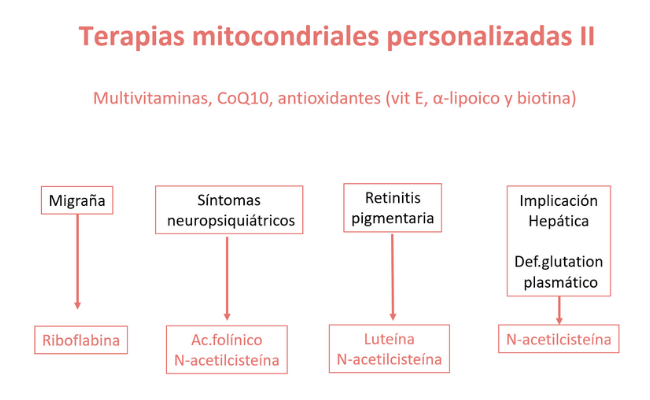
El futuro de la medicina mitocondrial requerirá personalización terapéutica basada en el diagnóstico molecular.
Referencias
Barcelos I, Shadiack E, Ganetzky RD, Falk MJ. Mitochondrial medicine therapies: rationale, evidence, and dosing guidelines. Curr Opin Pediatr. 2020 Dec;32(6):707-718.
Más información en Guía Metabólica
- 5941 lecturas