Tratamiento con cuerpos cetónicos exógenos
Resumen de la Cápsula metabólica presentada el 28 de mayo de 2021 por Dolores García Arenas, dietista-nutricionista en la Unidad de Enfermedades Metabólicas del Hospital Sant Joan de Déu Barcelona.

En condiciones normales, nuestro organismo utiliza los azúcares (hidratos de carbono) como fuente energética principal. Pero durante el ayuno prolongado, el cuerpo humano metaboliza los depósitos de grasa a través de la lipolisis.
Los ácidos grasos, mediante la beta-oxidación, dan lugar a acetil-CoA, precursor de la síntesis mitocondrial de energía (ATP). Además, el acetil-CoA, sintetiza los cuerpos cetónicos en el hígado (cetogénesis).
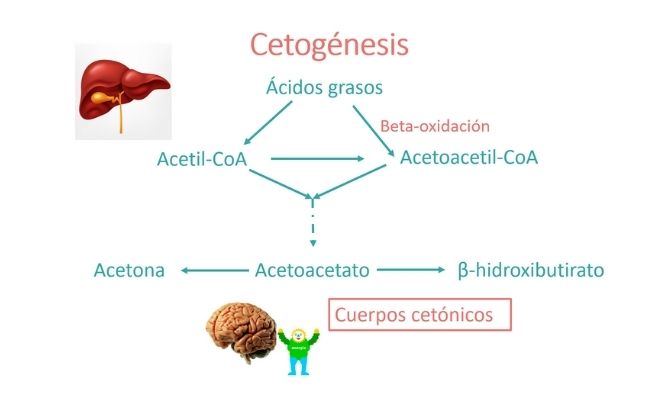
¿Qué son los cuerpos cetónicos?
Los cuerpos cetónicos, el β-hidroxibutirato (βHB), el acetoacetato y la acetona se producen durante el ayuno mediante el proceso de cetogénesis hepática, a partir de la β-oxidación de los ácidos grasos y tienen una importante función en el metabolismo energético.
¿Qué es la dieta cetogénica?
La dieta cetogénica consiste en generar una situación de cetosis (formación de cuerpos cetónicos) similar a la del ayuno prolongado, mediante la restricción de alimentos ricos en azúcares y el incremento de alimentos ricos en grasas, con un adecuado aporte proteico.
Como consecuencia de dicha dieta, la situación de cetosis es crónica, a diferencia de la causada por el ayuno, que tiene carácter temporal. Este cambio fundamental con respecto al método de producción de energía provoca alteraciones en numerosas vías bioquímicas, restaurando así la homeostasis energética y metabólica del cerebro.
Por ello, la dieta cetogénica es muy útil en numerosas enfermedades causadas o exacerbadas por un déficit de energía o una regulación metabólica anormal de la misma.
La producción endógena de cuerpos cetónicos (cetogénesis) es un proceso dinámico en el que intervienen múltiples factores y puntos de regulación, por lo que no es posible establecer con precisión las concentraciones de βHB que se generaran en sangre con las intervenciones (ayuno, dieta cetogénica) que dependen de la cetogénesis endógena.
¿Qué es la cetosis exógena?
El advenimiento de fuentes exógenas de cuerpos cetónicos, como las sales y los ésteres, ha permitido la manipulación precisa de la concentración sanguínea de los cuerpos cetónicos, dando lugar a un estado metabólico completamente nuevo: la cetosis exógena.
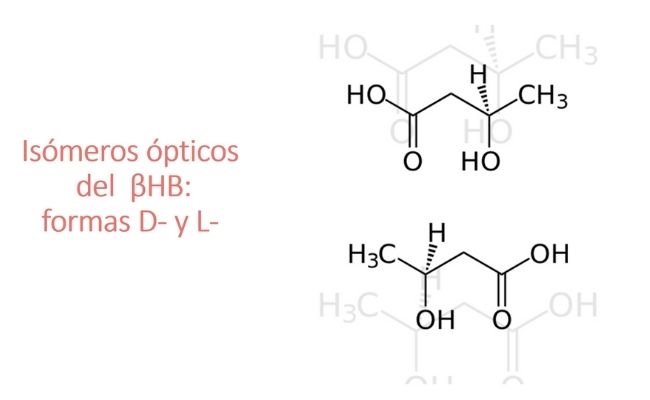
¿Qué son las sales y ésteres de βHB?
El βHB es muy ácido para consumirse directamente, pero pueden usarse dos tipos de derivados químicos para neutralizar esta acidez:
- Añadir al βHB una base para formar una sal (sodio, potasio o calcio).
- Esterificar el βHB con un precursor, como el 1,3-butanodiol (monoéster de βHB).
Sales de βHB
El uso de sales de βHB tiene algunos inconvenientes. Para lograr una concentración de βHB en sangre similar a la del ayuno se requiere el consumo de muchos gramos de sal. Además, la mayoría de las sales son racémicas, es decir, que tiene un 50 % de la forma D- bioactiva de βHB y un 50 % de la forma L- inactiva, que normalmente no se encuentra en la sangre. La forma D- es mejor absorbida en el intestino.
Las sales son hipertónicas, lo que las hace más propensas a producir diarrea.

Ester de βHB-butanodiol
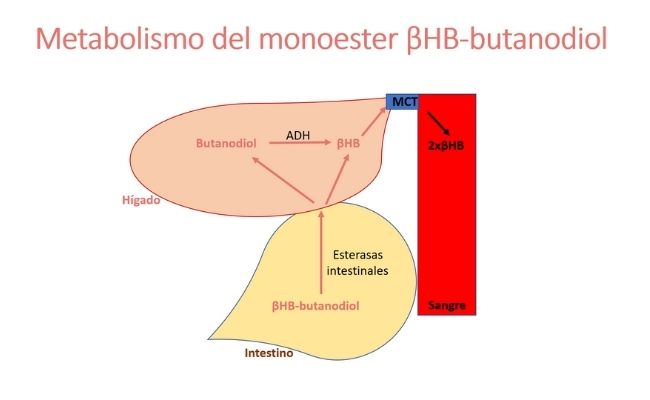
El butanodiol es un precursor de βHB, por lo que al administrar oralmente βHB-butanodiol, éste te metaboliza del modo siguiente. El enlace del monoéster de βHB-butanodiol se escinde por las esterasas intestinales, lo que produce βHB y butanodiol, que ingresan a la circulación portal.
En el hígado, la enzima alcohol deshidrogenasa (ADH) convierte el butanodiol en βHB, que pasa del hígado a la sangre mediante el transportador de monocarboxilato (MCT). Por tanto, cada molécula de monoéster produce dos equivalentes de βHB.

Ensayos clínicos realizados
Hasta el momento se han realizado diversos ensayos, tanto en animales de experimentación como en humanos, para conocer la eficacia de la suplementación exógena con sales y ésteres de βHB (ver referencias adjuntas). También se ha estudiado el efecto de una dieta cetogénica moderada combinada con la suplementación con monoéster de βHB.
Recientemente se ha publicado un estudio (Genetics in Medicine, 2020) en 23 pacientes pediátricos con deficiencia múltiple de acil-CoA deshidrogenasas (MADD) u otras enfermedades metabólicas similares tratados con D, L-3-HB. Edad mediana al inicio D, L-3-HB fue de siete meses. Las dosis de D, L-3-HB variaron entre 100 y 2600 mg / kg / día.
La D, L-3-HB (SIGMA-Aldrich) se administró por vía oral o por sonda gástrica/gastrostomía, generalmente combinada con nutrición o antes/después de la comida. Se observó una mejoría clínica en 16 pacientes (70 %) en relación con la miocardiopatía, leucodistrofia, síntomas hepáticos, síntomas musculares y/o insuficiencia respiratoria. D, L 3-HB no pareció ser eficaz para la neuropatía. La supervivencia aparece mayor con D, L-3-HB en comparación con los controles históricos de la enfermedad.
Los efectos secundarios incluyeron dolor abdominal, estreñimiento, deshidratación, diarrea y vómitos/náuseas. La duración media del tratamiento con D, L-3-HB fue de dos años. El tratamiento con HB se interrumpió en 12 pacientes (52 %).
Se concluye que el tratamiento con D, L-3-HB puede ser eficaz y seguro en pacientes con enfermedades metabólicas similares al MADD.
Conclusiones (Biochemical Society Transactions, 2020)
- La inducción de cetosis puede ser ampliamente beneficiosa en muchas enfermedades inducidas o agravadas por déficits energéticos o alteraciones de la regulación. Sin embargo, aumentar con seguridad y precisión la concentración de βHB en sangre es difícil con la mayoría de las intervenciones cetogénicas, siendo la suplementación con monoéster de βHB la excepción.
- Al producir solo la isoforma D-βHB y al estar libre de sal, el monoéster de βHB es un tratamiento prometedor. Además, su perfil farmacológico ha sido minuciosamente estudiado.
- La seguridad y tolerabilidad de consumir el monoéster de βHB, tres veces por día durante un mes, se ha demostrado en voluntarios sanos; sin embargo, se requieren estudios de seguridad y tolerabilidad específicos en las diferentes enfermedades que se beneficiarían de este tratamiento.
- Entre las aplicaciones clínicas más interesantes del monoéster de βHB están ciertas enfermedades crónicas. Sin embargo, debido a su vida media, los pacientes deberían consumir bebidas con frecuencia para mantener una concentración de βHB en sangre similar al ayuno durante un tiempo prolongado.
- El precio actual de sostener crónicamente la terapia con el monoéster de βHB impondría una enorme carga financiera para la mayoría de pacientes y sistemas de salud. Se necesita más investigación para evaluar el costo-beneficio específico para cada enfermedad.
- Finalmente, a pesar de la buena tolerabilidad reportada en algunos estudios, el sabor amargo puede perjudicar la adherencia, especialmente en niños, ancianos y enfermos críticos.
Referencias
- Soto-Mota A, Norwitz NG, Clarke K. Why a d-β-hydroxybutyrate monoester? Biochem Soc Trans. 2020 Feb 28;48(1):51-59.
- Soto-Mota A, Vansant H, Evans RD, Clarke K. Safety and tolerability of sustained exogenous ketosis using ketone monoester drinks for 28 days in healthy adults. Regul Toxicol Pharmacol. 2019 Dec;109:104506.
- Suissa L, Kotchetkov P, Guigonis JM, Doche E, Osman O, Pourcher T, Lindenthal S. Ingested Ketone Ester Leads to a Rapid Rise of Acetyl-CoA and Competes with Glucose Metabolism in the Brain of Non-Fasted Mice. Int J Mol Sci. 2021 Jan 7;22(2):524.
- Hashim SA, VanItallie TB. Ketone body therapy: from the ketogenic diet to the oral administration of ketone ester. J Lipid Res. 2014 Sep;55(9):1818-26.
- Whitfield J, Burke LM, McKay AKA, Heikura IA, Hall R, Fensham N, Sharma AP. Acute Ketogenic Diet and Ketone Ester Supplementation Impairs Race Walk Performance. Med Sci Sports Exerc. 2021 Apr 1;53(4):776-784.
- Van Rijt WJ, Jager EA, Allersma DP, Aktuğlu Zeybek AÇ, Bhattacharya K, Debray FG, Ellaway CJ, Gautschi M, Geraghty MT, Gil-Ortega D, Larson AA, Moore F, Morava E, Morris AA, Oishi K, Schiff M, Scholl-Bürgi S, Tchan MC, Vockley J, Witters P, Wortmann SB, van Spronsen F, Van Hove JLK, Derks TGJ. Efficacy and safety of D,L-3-hydroxybutyrate (D,L-3-HB) treatment in multiple acyl-CoA dehydrogenase deficiency. Genet Med. 2020 May;22(5):908-916.
Más información en Guia Metabólica:
- 6013 lecturas



