Guía clínica para el diagnóstico y tratamiento de la acidemia metilmalónica y la acidemia propiónica: Primera revisión
Forny P, Hörster F, Ballhausen D, Chakrapani A, Chapman KA, Dionisi-Vici C, Dixon M, Grünert SC, Grunewald S, Haliloglu G, Hochuli M, Honzik T, Karall D, Martinelli D, Molema F, Sass JO, Scholl-Bürgi S, Tal G, Williams M, Huemer M, Baumgartner MR. Guidelines for the diagnosis and management of methylmalonic acidaemia and propionic acidaemia: First revision. J Inherit Metab Dis. 2021 May;44(3):566-592. doi: 10.1002/jimd.12370. Epub 2021 Mar 9. PMID: 33595124.

La acidemia metilmalónica aislada (MMA) y la acidemia propiónica (PA) son enfermedades metabólicas hereditarias poco frecuentes. Hace seis años, se publicó por primera vez una evaluación detallada de la evidencia disponible sobre el diagnóstico y el tratamiento de estos trastornos. El artículo recibió una atención considerable, lo que ilustra la importancia de un panel de expertos que evalúen y elaboren recomendaciones para orientar la atención al paciente con enfermedades raras. Desde entonces, un creciente cuerpo de evidencia sobre los resultados de los trasplantes en pacientes con MMA y PA y el uso de mezclas de aminoácidos libres de precursores permite actualizar las pautas.
En este artículo, nuestro objetivo es incorporar este conocimiento recién publicado y proporcionar una versión revisada de las pautas. El análisis fue realizado por un panel de expertos multidisciplinarios en atención médica, que siguieron una metodología de desarrollo de guías actualizada (GRADE). Por lo tanto, se reevaluó, analizó y calificó todo el conjunto de pruebas hasta el otoño de 2019. Como resultado, se elaboraron 21 recomendaciones actualizadas en un documento más conciso, con un enfoque en la evidencia existente, para permitir decisiones bien informadas en el contexto de la atención al paciente de MMA y PA.
1ª versión de la guía clínica
Baumgartner MR, Hörster F, Dionisi-Vici C, Haliloglu G, Karall D, Chapman KA, Huemer M, Hochuli M, Assoun M, Ballhausen D, Burlina A, Fowler B, Grünert SC, Grünewald S, Honzik T, Merinero B, Pérez-Cerdá C, Scholl-Bürgi S, Skovby F, Wijburg F, MacDonald A, Martinelli D, Sass JO, Valayannopoulos V, Chakrapani A. Proposed guidelines for the diagnosis and management of methylmalonic and propionic acidemia. Orphanet J Rare Dis. 2014 Sep 2;9:130. doi: 10.1186/s13023-014-0130-8. PMID: 25205257; PMCID: PMC4180313.
¿Qué son las acidemias metilmalónica (MMA) y propiónica (PA)?
La MMA está causada por una deficiencia de la enzima metilmalonil-CoA mutasa (MMUT), ya sea por un defecto directo de la enzima o por una síntesis deficiente de su cofactor adenosilcobalamina (AdoCbl). Precursores de esta vía derivan de aminoácidos específicos (valina, isoleucina, treonina, metionina), el propionato producido por bacterias intestinales y ácidos grasos de cadena impar, así como la cadena lateral del colesterol. En la MMA aislada, se incluyen los siguientes defectos genéticos: deficiencias de MMUT, MMAA (CblA), MMAB (CblB) y mutaciones hacia la posición N-terminal en el gen MMADHC causantes de proteína truncada.
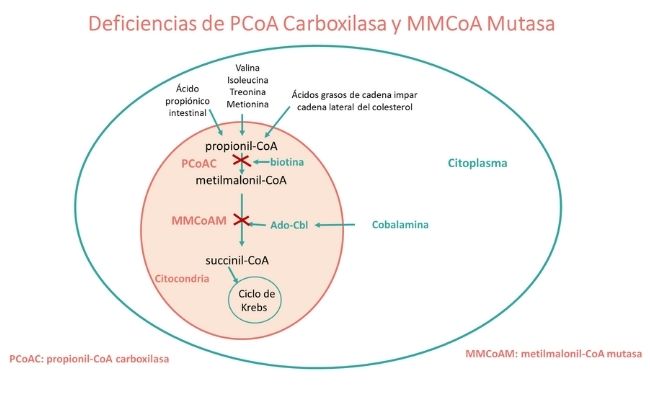
La PA está causada por mutaciones en los genes PCCA o PCCB, lo que da lugar a una deficiencia de la función de la enzima propionil-CoA carboxilasa.
Objetivos
El propósito de esta guía es la utilidad a los profesionales de la salud que atienden pacientes con MMA y PA, como una referencia basada en la evidencia para brindar una atención óptima al paciente. Sin embargo, las pautas no reemplazan la reflexión clínica integral y la evaluación de la situación individual de cada paciente.
Estas pautas intentan proporcionar una guía donde hay evidencia suficiente, mientras que al mismo tiempo identifican las lagunas de conocimiento, que aún no permiten la evidencia.
Método
La revisión de esta guía clínica para MMA y PA fue realizada por un panel de 21 profesionales de la salud que trabajan en el campo de la medicina metabólica. Estas pautas utilizan un sistema diferente y más actualizado para evaluar la evidencia que el usado en la primera versión de 2014, el 'Grading of Recommendations, Assessment, Development and Evaluation' (GRADE), que es más adecuado en el campo de las enfermedades raras, ya que explica parcialmente los retos que conllevan.
Guía clínica
Parámetros de resultados
Un parámetro de resultado refleja una entidad específica por la cual un paciente que padece MMA o PA puede verse afectado. Esto puede ser un signo clínico (p. ej., disfunción renal o miocardiopatía) o una combinación compleja de varios factores (p. ej., calidad de vida relacionada con la salud o estabilidad metabólica). Los profesionales de la salud y los representantes de los pacientes calificaron cada parámetro de resultado de 0 (menor importancia) a 9 (el más crítico para la toma de decisiones). Por orden decreciente de importancia del resultado se calificaron: Supervivencia y calidad de vida relacionada con la salud (9), estabilidad metabólica, desarrollo cognitivo y epilepsia (8), accidente cerebrovascular de origen metabólico, visión y audición, diagnóstico precoz, miocardiopatía y disfunción renal (7), pancreatitis, crecimiento normal y neutropenia (6), anemia (5,5) y salud ósea (5).
Las siguientes recomendaciones están estructuradas de acuerdo con la evolución natural del paciente, desde la presentación inicial y los procedimientos de diagnóstico, hasta el tratamiento, las complicaciones a largo plazo y la monitorización. Cada una de las recomendaciones se refiere directamente a un resultado.
Retos del diagnóstico
Presentación clínica
| Tabla 1. Posibles signos y síntomas de presentación en pacientes con MMA y PA | |
| Presentación aguda | Presentación crónica |
| Sistema nervioso | |
| Encefalopatía aguda | Hipotonía |
| Convulsiones | Retraso en el desarrollo |
| Trastornos del movimiento (+ en PA) | Convulsiones |
| Episodios similares a un accidente cerebrovascular (más frecuentes en MMA) | Trastornos del movimiento / distonía |
| Sistema gastrointestinal | |
| Vómitos | Vómitos recurrentes con cetoacidosis |
| Dificultades para alimentarse | Fallo de medro |
| Pancreatitis | |
| Sistema hematopoyético | |
| Neutropenia, pancitopenia | Neutropenia, pancitopenia |
| Corazón (principalmente en PA) | |
| Insuficiencia cardíaca aguda (principalmente miocardiopatía) | Miocardiopatía |
| Arritmias, QTc prolongado en ECG | Intervalo QTc prolongado en ECG |
| Riñón | |
| Fallo renal crónico (casi exclusivamente en MMA) | |
Un paciente solo puede ser diagnosticado de MMA o PA si el médico reconoce el cuadro clínico que sugiere estas enfermedades, lo que puede ser un reto, ya que muchos de los signos clínicos son inespecíficos. La MMA y PA pueden presentarse con síntomas agudos, crónicos o intermitentes, que a menudo pueden agravarse o incluso ocurrir por primera vez después de un evento "desencadenante" (Tabla 1).
Recomendación n. ° 1: Recomendamos encarecidamente considerar la MMA y la PA en el diagnóstico diferencial de un deterioro neurológico agudo o intermitente y en el diagnóstico diferencial de la sepsis neonatal.
Resultado: supervivencia.
Calidad de la evidencia: moderada.
Recomendación: muy fuerte (respaldada por conocimientos médicos).
Diagnóstico de laboratorio
Cuando, en base a la evaluación clínica y los parámetros básicos de laboratorio o en un resultado anormal del cribado neonatal, se sospecha una acidemia orgánica, el diagnóstico de MMA o PA se logra mediante análisis de ácidos orgánicos en la orina (Tabla 2). Las elevaciones de ácido metilmalónico junto con 3-hidroxipropionato y la presencia de 2-metilcitrato confirman el diagnóstico de MMA, mientras que el mismo patrón sin niveles anormales de ácido metilmalónico está presente en la PA.
A menudo se pueden encontrar en la PA, tiglilglicina y propionilglicina. El diagnóstico puede complementarse con el análisis de acilcarnitinas en gotas de sangre seca (SS) o plasma. En esta prueba, se puede encontrar una elevación importante de acilcarnitina C3 (propionilcarnitina) tanto en MMA como en PA. Además, la valoración de aminoácidos en plasma muestra niveles elevados de glicina en la MMA y PA.
Diagnóstico diferencial
La enzima metilmalonil-CoA mutasa puede ser disfuncional debido a varios defectos genéticos diferentes, todos los cuales conducen a un nivel elevado de ácido metilmalónico en la orina y en la sangre. El diagnóstico diferencial del ácido metilmalónico elevado conlleva una serie de enfermedades.
Específicamente, el ácido metilmalónico puede elevarse debido a un defecto en MMUT o uno de los genes distales en la vía de la cobalamina intracelular, causando los subtipos de MMA discutidos en estas guías, o debido a defectos más proximales en la vía de la cobalamina intracelular, así como por deficiencia nutricional de cobalamina.
Para diferenciar las enfermedades discutidas en estas guías de las más proximales y el suministro de cobalamina alterado, se deben medir los niveles de homocisteína y vitamina B12 en sangre, que se espera que sean normales en MMA aislada (excepto en el caso de deficiencia nutricional concomitante incidental de vitamina B12). La magnitud de la elevación del ácido metilmalónico puede ayudar aún más a clasificar los diferentes defectos en la vía (Tabla 2).
Además, otros defectos genéticos raros conducen a una elevación aislada, aunque más leve, de ácido metilmalónico con homocisteína normal, pero no forman parte de estas pautas. Estos genes incluyen MCEE, que codifica metilmalonil-CoA epimerasa, y SUCLG1, SUCLA2, que codifica succinato-CoA ligasa, y otros.
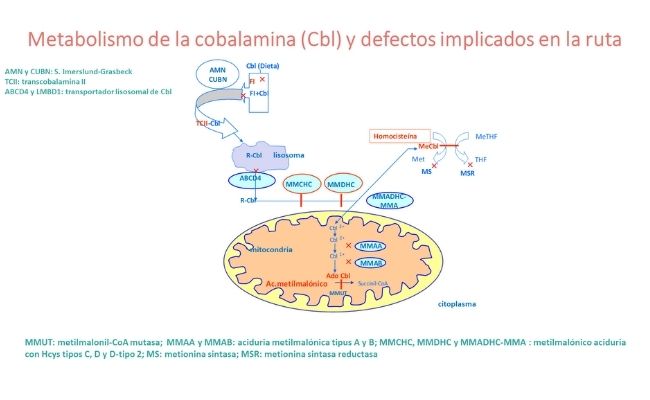
Como la enzima propionil-CoA carboxilasa requiere biotina como cofactor, la deficiencia nutricional de biotina o un defecto de las enzimas biotinidasa (gen BTD) o holocarboxilasa sintetasa (gen HLCS) debe excluirse para finalizar el diagnóstico de PA.
En todos estos casos, los perfiles de ácidos orgánicos urinarios no solo incluirían niveles elevados de los metabolitos patognomónicos del PA (3-hidroxipropionato y 2-metilcitrato), sino también otros metabolitos derivados de deficiencias de otras carboxilasas dependientes de biotina como la metilcrotonilglicina.
Tanto la MMA como la PA se heredan de forma autosómica recesiva. Para confirmar el diagnóstico bioquímico, orientar el manejo y permitir el consejo genético de las familias, es necesario identificar el defecto genético subyacente.
La MMA aislada puede ser causada por defectos en cuatro genes diferentes, incluidos MMUT (subtipos mut), MMAA (cblA), MMAB (cblB), MMADHC (cblD-MMA). Las mutaciones específicas en MMADHC también pueden conducir a un fenotipo combinado de MMA y homocistinuria u homocistinuria aislada. En el caso raro de resultados genéticos no concluyentes, los estudios de complementación, el ensayo de incorporación de propionato o las mediciones de la actividad enzimática en los fibroblastos pueden ayudar en el proceso de diagnóstico.
Muchas de las mutaciones conocidas de MMUT se han probado funcionalmente con los ensayos antes mencionados, lo que permite la clasificación histórica como un subtipo mut0 (sin respuesta a la suplementación con hidroxocobalamina en el ensayo de incorporación de propionato) o un subtipo mut- (aumento de la incorporación de propionato tras la adición de hidroxocobalamina al medio de cultivo celular).
| Tabla 2. Alteraciones bioquímicas en la PA y condiciones con el MMA elevado | |||||||
| Orina | SS o plasma | Plasma | |||||
| MMA | 3-OH-propionato | 2-metil-citrato |
Propionil- carnitina |
Homo-cisteína | Vit B12 | Holotrans-cobalamina | |
| Enfermedades tratadas en esta guía clínica | |||||||
| MMA | ↑↑↑ | ↑ | ↑ | ↑↑ | n | n | n |
| PA | n | ↑ | ↑(↑) | ↑↑(↑) | n | n | n |
| Otros defectos que causan aumento de MMA | |||||||
| MCEE | ↑ | (↑) | (↑) | (↑) | n | n | n |
| ACSF3 | ↑ | n | n | n | n | n | n |
|
Def. de MCbl y AdoCbl |
↑↑↑ | ↑ | ↑ | ↑↑↑ | ↑↑↑↑ | n | n |
| Defecto Trans-Cbl | ↑ | n/↑ | n/↑ | n/↑ | ↑ | n/↓ | n/↓ |
|
Def. Recep. Trans-Cbl |
↑ | sd | sd | sd | n/↑ | sd | sd |
| Def. FI y S.IG | ↑↑↑ | n/↑ | n/↑ | n/↑ | ↑↑↑ | ↓↓ | ↓ |
|
Def. nutric. VitB12 |
↑↑↑ | n/↑ | n/↑ | n/↑ | ↑↑↑ | ↓↓↓ | ↓↓↓ |
| MMA, acidemia metilmalónica; PA: acidemia propiónica; MCEE, metilmalonil CoA epimerasa; ACSF3, acil-CoA sintetasa 3; IF, factor intrínseco; Cbl: cobalamina; n, normal; sd, sin datos. | |||||||
En el caso de la PA, no hay evidencia de que la identificación del defecto genético subyacente (en PCCA o PCCB) pueda guiar el tratamiento o el pronóstico, ya que no se conoce correlación genotipo-fenotipo. Sin embargo, la confirmación genética molecular de la enfermedad es útil para el consejo genético y posible diagnóstico prenatal.
Recomendación # 3 Sugerimos pruebas de genética molecular en cualquier paciente con un diagnóstico bioquímico de MMA y PA para confirmar el diagnóstico, asignación a subgrupos (mut0, mut−, cblA, cblB, cblD-MMA), consejo genético y para permitir el diagnóstico prenatal.
Resultado: diagnóstico precoz.
Calidad de la evidencia: moderada.
Fuerza de la recomendación: débil.
Diagnóstico prenatal
El diagnóstico prenatal se realiza preferentemente mediante análisis moleculares en el ADN fetal. Los análisis bioquímicos para MMA o PA se pueden utilizar como método alternativo o adicional en los casos en que los resultados genéticos no sean concluyentes o no estén disponibles.
El diagnóstico prenatal de MMA se puede realizar mediante la medición de MMA en líquido amniótico seco y de PA mediante la determinación de 2-metilcitrato con el mismo método. La combinación de dos métodos independientes (bioquímico y genético) aumenta la fiabilidad de los resultados. Esta guía solo recomienda sobre el modo de diagnóstico prenatal y no aborda valores y consideraciones individuales, culturales y éticas.
Recomendación # 4: Sugerimos el uso de pruebas genéticas para el diagnóstico prenatal de MMA y PA.
Resultado: diagnóstico precoz.
Calidad de la evidencia: moderada.
Fuerza de la recomendación: débil.
Cribado neonatal
Se ha demostrado que el cribado neonatal aumenta la posibilidad de un diagnóstico precoz de los pacientes con MMA y PA, especialmente en los casos de inicio tardío. Si bien el cribado neonatal puede reducir la mortalidad neonatal, puede no prevenir la descompensación metabólica neonatal, posiblemente debido al retraso hasta que el resultado del cribado neonatal esté disponible. Además, es posible que el cribado neonatal no mejore parámetros importantes de los resultados, incluida la estabilidad metabólica y el desarrollo cognitivo.
No obstante, análisis del perfil de acilcarnitinas en niños con signos y síntomas clínicos sugestivos puede evitar un retraso significativo en el diagnóstico. Por ahora, no existe suficiente evidencia para permitir una recomendación general a favor o en contra del cribado neonatal de MMA y PA en el futuro.
Manejo de MMA y PA
Tratamiento inicial
El diagnóstico temprano y el tratamiento oportuno son esenciales para mejorar la supervivencia y reducir la morbilidad en pacientes con MMA y PA. Con el tiempo, la supervivencia de estos pacientes ha mejorado, probablemente debido a mejores estrategias de tratamiento y seguimiento de los pacientes. Sin embargo, el efecto del tratamiento sobre la supervivencia no está claro a partir de la evidencia actual.
En los pacientes con MMA, la supervivencia también depende de la edad de inicio y del subtipo de enfermedad; los pacientes con MMA de inicio temprano, en particular los pacientes con mut0 y cblB, tienen un mayor riesgo de mortalidad.
Tan pronto como se sospeche el diagnóstico de MMA y AP, se deben iniciar terapias específicas y se debe derivar al paciente a un centro especializado ya que algunos de los tratamientos y el conocimiento especializado solo están disponibles allí. Puede ser necesario el tratamiento de cuidados intensivos de pacientes con descompensación metabólica si hay una acidosis metabólica grave con o sin hiperamonemia e hiperlactatemia.
Según las opiniones de expertos la mejor forma de abordar el tratamiento de una descompensación metabólica aguda (inminente) en pacientes con MMA y PA se resume en la siguiente figura.
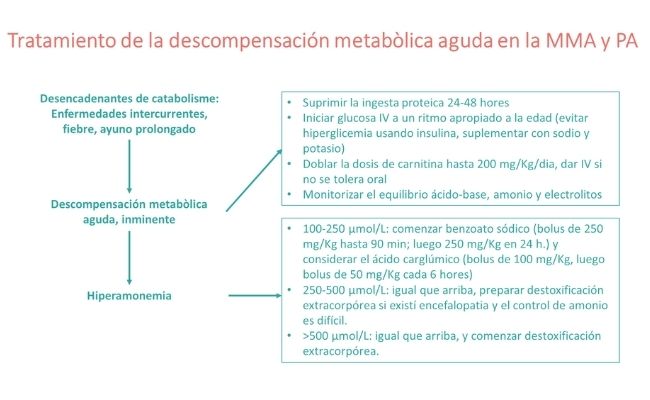
Recomendación # 5: Si se sospecha el diagnóstico de MMA o PA, sugerimos un tratamiento específico inmediato para mejorar la supervivencia en MMA y PA.
Resultado: supervivencia.
Calidad de la evidencia: moderada.
Fuerza de la recomendación: débil.
Estabilidad metabólica
La estabilidad metabólica es la ausencia de hospitalización y exacerbación de los signos y síntomas de la enfermedad, especialmente acidosis metabólica e hiperamonemia. Según esta definición, la estabilidad metabólica es un término complejo, ya que está influenciado por varios factores.
Los niveles de metabolitos, como el ácido metilmalónico, la propionilcarnitina y los aminoácidos plasmáticos, se utilizan a menudo como marcadores de la estabilidad metabólica. Sin embargo, la evidencia actual sugiere depender de la evaluación clínica, incluida la revisión de la historia clínica y la medición de parámetros bioquímicos simples, como el equilibrio ácido-base, cetonas urinarias y amonio plasmático, en el contexto agudo para discriminar entre una situación metabólicamente estable o de descompensación. Recientemente, la medición del factor de crecimiento de fibroblastos 21 (FGF21) y del 2-metilcitrato mostraron potencial para predecir el desarrollo de complicaciones a largo plazo.
Los desencadenantes de descompensación metabólica incluyen infecciones, que causan fiebre y catabolismo. De manera similar, los períodos de ayuno prolongados provocan catabolismo y deben evitarse para prevenir la inestabilidad metabólica. En una enfermedad intermitente leve, se aplican alimentos enterales de emergencia, que consisten en una solución de polímero de glucosa (ocasionalmente con emulsión grasa), que proporcionan la energía adecuada y satisfacen las demandas metabólicas elevadas. Las tomas de emergencia solo deben administrarse durante un tiempo limitado, y si se toleran, es decir, ausencia de vómitos y diarreas.
Paralelamente, la ingesta de proteínas se detiene o se reduce parcialmente, por ejemplo, al 50 %, dependiendo de la gravedad de los síntomas clínicos. Se proporciona (artículo original) una descripción general simplificada de los regímenes de emergencia dependientes de la edad basados en la solución de polímero de glucosa. De manera similar, la anestesia general requiere consideraciones específicas para asegurar un suministro de energía adecuado y una estabilidad metabólica.
Las vacunas no parecen desencadenar la descompensación por sí mismas, por lo que se están indicados los protocolos de vacunación regulares.
Recomendación # 6: Recomendamos evitar el metabolismo catabólico en pacientes con MMA y PA para mejorar la estabilidad metabólica.
Resultado: estabilidad metabólica.
Calidad de la evidencia: moderada.
Fuerza de la recomendación: fuerte (respaldada por conocimientos médicos basados en la experiencia).

En general, una dieta baja en proteínas naturales tiene como objetivo la reducción de moléculas precursoras que se metabolizan por la vía defectuosa en MMA y PA. La práctica actual del tratamiento dietético de los pacientes con MMA y PA tiene como objetivo la estabilidad metabólica y el crecimiento normal.
Se basa en un aporte energético adecuado, evitar ayunos prolongados y una ingesta reducida de aminoácidos precursores (metionina, treonina, valina, isoleucina) mediante una dieta restringida en proteínas naturales, y un aporte adecuado de vitaminas, minerales y oligoelementos y ácidos grasos esenciales para la edad. La cantidad de proteína natural debe evaluarse individualmente y debe basarse en un seguimiento clínico y bioquímico.
La lactancia materna es posible considerando la ingesta total de proteínas naturales. Sin embargo, no hay datos suficientes para definir una estrategia dietética detallada basada en la evidencia en MMA y PA.
Recomendación # 7: Sugerimos una dieta baja en proteínas naturales teniendo en cuenta los requisitos de proteína total apropiados para la edad para mejorar la estabilidad metabólica.
Resultado: estabilidad metabólica.
Calidad de la evidencia: baja.
Fuerza de la recomendación: débil.
También se utilizan los siguientes medicamentos específicos para facilitar la estabilidad metabólica. El tratamiento con levocarnitina, generalmente a una dosis de 100 mg/kg/ día, se aplica para restaurar los niveles de carnitina y CoA agotados en pacientes con MMA y PA, y se basa en su capacidad para unirse y eliminar las moléculas de propionil-CoA, que se supone que son responsables de algunos de los efectos de metabolitos tóxicos en MMA y PA. Al menos en PA, la levocarnitina podría mejorar la estabilidad metabólica y ayudar a evitar crisis hiperamonémicas. La levocarnitina se considera un medicamento bien tolerado con pocos efectos secundarios.
El metronidazol, de 10 a 20 mg/kg/día en dos o tres dosis, ha sido parte del tratamiento estándar a largo plazo para reducir la producción de propionato bacteriano en el intestino, a pesar de que hay poca evidencia de beneficio. No se ha demostrado que la neuropatía sea una complicación intrínseca a largo plazo en MMA o PA, pero se ha observado neuropatía periférica en pacientes con PA bajo tratamiento con metronidazol y el metronidazol es una causa conocida de neuropatía periférica, así como también de intervalo QTc prolongado y pancreatitis; por lo tanto, el tratamiento con metronidazol debe indicarse con precaución. Si no se tolera bien, existen antibióticos alternativos, que incluyen amoxicilina o cotrimoxazol.
El ácido carglúmico puede reducir consistentemente el número de descompensaciones metabólicas, suministrando citrato al ciclo de Krebs, pero este tratamiento requiere mayor evidencia.
Recomendación # 8: sugerimos la suplementación con levocarnitina para mejorar la estabilidad metabólica.
Resultado: estabilidad metabólica.
Calidad de la evidencia: baja.
Fuerza de la recomendación: débil.
Algunos pacientes con MMA se benefician claramente del tratamiento con cobalamina parenteral. Los pacientes con cblA mejorarán en su mayoría, y se ha descrito que cblB responde en un tercio de los casos. Entre los pacientes con deficiencia de MMUT, hay evidencia clara de respuesta a la cobalamina en mut -. La vía de aplicación ideal es intramuscular y la hidroxocobalamina es la forma preferida de la molécula de cobalamina.
Se ha propuesto previamente un protocolo para evaluar la respuesta bioquímica:
(a) El paciente debe estar metabólicamente estable sin cambios recientes en el tratamiento.
(b) El paciente debe dejar de tomar suplementos de hidroxocobalamina durante al menos 1 mes antes de la evaluación.
(c) Recoger al menos tres muestras de orina o plasma (use siempre el mismo fluido corporal) en días diferentes para medir el ácido metilmalónico.
(d) Inyectar 1 mg de hidroxocobalamina por vía intramuscular durante tres días consecutivos.
(e) Recoger muestras de orina o plasma durante 10 días, cada dos días.
(f) Una disminución media de la concentración de ácido metilmalónico en orina o plasma de > 50 % se considera una respuesta significativa.
No se recomienda un tratamiento similar con biotina para los pacientes con AP, ya que hasta ahora no se ha descrito que los pacientes respondan.
Recomendación # 9: Recomendamos evaluar la capacidad de respuesta a la vitamina B12 parenteral en todos los pacientes con sospecha de MMA.
Resultado: estabilidad metabólica.
Calidad de la evidencia: moderada.
Fuerza de la recomendación: fuerte (respaldada por conocimientos bioquímicos básicos).
El trasplante de hígado en MMA o PA y el trasplante combinado de hígado-riñón, así como el trasplante de riñón en MMA, se ha realizado en varios pacientes para mejorar el resultado de la enfermedad, aunque es difícil proporcionar recomendaciones detalladas sobre este tema (evidencia incompleta). Hemos identificado cerca de 300 pacientes con MMA y PA, y se concluye el trasplante en pacientes con MMA y PA tienen beneficios potenciales, así como riesgos asociados. Sugerimos considerar el diagrama de flujo de manejo para pacientes con MMA y PA sometidos a anestesia general que se muestra en la anterior, al realizar cualquier procedimiento de trasplante.
Después de un trasplante de hígado y/o riñón, el número de descompensaciones metabólicas disminuye y algunos reportan un menor tiempo de ingreso hospitalario durante una enfermedad intermitente. También parecen mejorar los marcadores bioquímicos. Sin embargo, aún pueden ocurrir descompensaciones metabólicas agudas después del trasplante y algunas de estas descompensaciones son letales. Por lo tanto, están indicados el seguimiento por un clínico especialista en metabolismo y una monitorización metabólica regular. Se debe evitar el trasplante de órganos de pacientes en descompensación metabólica aguda, ya que el procedimiento en sí tiene el potencial causar una mayor descompensación.
En pacientes trasplantados con MMA y PA se han aplicado, tanto la normalización de la dieta, la liberalización, el aumento de la ingesta de proteínas como la continuación de las restricciones dietéticas después del trasplante. Tanto la dieta liberalizada como la continua condujeron a situaciones metabólicamente estables sin descompensación aguda. Hasta que la evidencia sea más clara, parece apropiada la atención adicional por parte de un especialista en metabolismo, incluida la monitorización bioquímica y la revisión dietética regular, así como la continuación de la levocarnitina.
Recomendación # 10. Sugerimos considerar el trasplante de hígado en MMA y PA, y el trasplante combinado de hígado y riñón en MMA para mejorar la estabilidad metabólica.
Resultado: estabilidad metabólica.
Calidad de la evidencia: baja.
Fuerza de la recomendación: débil.
Complicaciones a largo plazo de MMA y PA
Con una mejor supervivencia, las complicaciones a largo plazo son más evidentes, incluidas las afecciones desconocidas hasta ahora, como las neoplasias hepáticas. Es fundamental reconocer que, a pesar de la mejora de la supervivencia, las descompensaciones metabólicas siguen siendo una de las principales causas de mortalidad, y puede producirse muerte súbita por síndrome de QT prolongado o miocardiopatía.
Complicaciones neurológicas
Existen una serie de problemas neurológicos asociados con la MMA y PA. Debido a su complejidad, se dividen en secciones separadas según los parámetros de resultado: desarrollo cognitivo, accidente cerebrovascular metabólico, epilepsia y discapacidad visual y auditiva.
Si bien algunos pacientes muestran estabilización e incluso mejoría de los síntomas neurológicos después del trasplante de órganos, otros todavía tienen riesgo de desarrollar complicaciones neurológicas. El desarrollo cognitivo a menudo permanece estable o mejora después del trasplante de hígado y riñón-hígado para MMA, y trasplante de hígado para PA.
Sin embargo, varias nuevas secuelas neurológicas (graves) se produjeron después del trasplante: convulsiones, ictus metabólico, síndrome de Leigh, empeoramiento de la visión y leucoencefalopatía focal, neuropatía motora generalizada y deterioro neurológico general en pacientes con MMA; e ictus metabólico, epilepsia y esclerosis mesial temporal en pacientes con AP.
Desarrollo cognitivo y complicaciones psiquiátricas
En MMA, la falta de respuesta a la cobalamina, la aparición precoz de la enfermedad, la presencia de hiperamonemia o convulsiones al inicio y un subtipo mut0 se asocian con una afectación cognitiva más grave, mientras que todos los pacientes muestran déficits selectivos en la velocidad de procesamiento. El 20 % de los pacientes con MMA se ven afectados por problemas neuropsiquiátricos. El número de descompensaciones metabólicas impacta negativamente en el resultado cognitivo, lo que indica que una mejor estabilidad metabólica podría mejorar los problemas cognitivos.
La PA parece estar generalmente asociada a un deterioro cognitivo, que en la mayoría de los estudios supera el 50 % de los pacientes evaluados. Además, se describen el trastorno del espectro autista, la ansiedad y los episodios psicóticos agudos. La evidencia actual sugiere que la intervención y el tratamiento tempranos tienen poco efecto sobre el resultado cognitivo en la PA.
Recomendación # 11: Sugerimos pruebas de desarrollo, cognitivas y conductuales estandarizadas y apropiadas para la edad, ya que el retraso en el desarrollo, la discapacidad intelectual y/o las anomalías del comportamiento son complicaciones conocidas en MMA y PA.
Resultado: desarrollo cognitivo.
Calidad de la evidencia: moderada.
Fuerza de la recomendación: débil.
Accidente cerebrovascular metabólico
El ictus metabólico es la aparición aguda de un déficit neurológico central, a menudo asociado con una descompensación del error innato del metabolismo subyacente, que no puede ser explicado por hipoxemia o insuficiencia vascular.
Recomendación # 12: Recomendamos una investigación estándar adecuada para un accidente cerebrovascular metabólico, si los pacientes con MMA o PA presentan síntomas sospechosos de un episodio similar a un accidente cerebrovascular.
Resultado: accidente cerebrovascular metabólico.
Calidad de la evidencia: alta.
Fuerza de recomendación: muy fuerte.
Epilepsia
La epilepsia es una complicación común en MMA (prevalencia del 23 % -43 %) y PA (prevalencia del 25 % -59 %). Incluso se han descrito convulsiones como la forma de presentación de la enfermedad antes del diagnóstico en varios casos de PA. La evaluación del electroencefalograma debe realizarse en presencia de cualquier síntoma neurológico focal o convulsiones sospechadas clínicamente, y el tratamiento con fármacos antiepilépticos debe iniciarse en consecuencia. Se requiere precaución cuando se usa ácido valproico, ya que puede disminuir la concentración de levocarnitina por excreción de valproilcarnitina.
Recomendación # 13: Recomendamos monitorizar los síntomas de la epilepsia en pacientes con MMA y PA, ya que las convulsiones son una complicación común.
Resultado: epilepsia.
Calidad de la evidencia: moderada.
Fuerza de recomendación: muy fuerte.
Visión y audición
La neuropatía óptica es una de las complicaciones neurológicas a largo plazo tanto de MMA como de PA, que ocurren en la infancia o más tarde durante el curso de la enfermedad, y afecta aproximadamente al 25 % de los pacientes. El inicio de la neuropatía óptica puede ser insidioso y subclínico o agudo.
La hipoacusia neurosensorial parece ser menos común, pero se ha descrito en varios casos de pacientes con MMA y PA.
Recomendación # 14. Sugerimos monitorizar la función visual y auditiva, ya que la neuropatía óptica y la pérdida auditiva neurosensorial son complicaciones conocidas en MMA y PA.
Resultado: visión y audición.
Calidad de la evidencia: moderada.
Fuerza de la recomendación: débil.
Disfunción renal
La insuficiencia renal es una complicación a largo plazo bien documentada en MMA y menos frecuente en PA. La aparición de disfunción renal está relacionada con el subtipo molecular: los pacientes mut0 se ven afectados más tempranamente que los pacientes con cblB; los pacientes con cblA y mut− parecen verse afectados incluso más tardíamente. A pesar de estas diferencias, se cree que todos los pacientes con MMA aislada tienen riesgo de desarrollar insuficiencia renal a largo plazo.
Aunque la disfunción renal en PA solo se describe en casos aislados, puede ser grave, incluso requiriendo el trasplante del órgano disfuncional.
Recomendación # 15: Recomendamos encarecidamente el control de la función renal, ya que la enfermedad renal crónica es una complicación en MMA y PA.
Resultado: disfunción renal.
Calidad de la evidencia: alta.
Fuerza de recomendación: muy fuerte.
Cardiopatía
La miocardiopatía ocurre en pocas MMA y en aproximadamente el 25 % de los pacientes con PA. La miocardiopatía puede presentarse como un hallazgo clínico aislado en individuos previamente asintomáticos. No parece haber correlación entre la aparición de miocardiopatía y la estabilidad metabólica, la gravedad del fenotipo o la actividad enzimática residual. La miocardiopatía puede progresar rápidamente y provocar insuficiencia cardíaca o incluso la muerte. En base a las complicaciones cardíacas descritas anteriormente, sugerimos el uso de electrocardiograma y ecocardiograma para una monitorización regular (Tabla 5).
Recomendación # 16. Recomendamos encarecidamente los exámenes cardíacos regulares, ya que la miocardiopatía en MMA y PA y el síndrome de QT prolongado en PA son complicaciones potencialmente mortales.
Resultado: enfermedad cardíaca.
Calidad de la evidencia: alta.
Fuerza de recomendación: muy fuerte.
Complicaciones hematológicas
Las anomalías hematológicas son frecuentes en MMA y PA. Se ha descrito con frecuencia pancitopenia (especialmente neutropenia) en la presentación inicial o durante la descompensación metabólica, así como durante el curso de la enfermedad crónica. La trombocitopenia aislada puede observarse durante las descompensaciones metabólicas agudas. La anemia puede presentarse más bien de forma crónica y depender de otros factores como la presencia de enfermedad renal crónica. Otros mecanismos postulados incluyen efectos supresores reversibles de metabolitos tóxicos sobre la función de la médula ósea.
Recomendación # 17. Sugerimos la monitorización del hemograma completo durante el seguimiento regular y en caso de descompensación metabólica, ya que la anemia, neutropenia y/o trombocitopenia pueden ser una complicación en pacientes con MMA y PA.
Resultado: complicaciones hematológicas.
Calidad de la evidencia: moderada.
Fuerza de la recomendación: débil.
La salud ósea
Los pacientes con MMA y PA tienen riesgo de baja densidad ósea y osteoporosis, que pueden agravarse por la disfunción renal en MMA. Los factores de riesgo pueden incluir acidosis crónica (que causa la activación de los osteoclastos y la inhibición de los osteoblastos), función renal alterada e ingesta dietética inadecuada de calcio, fosfato y vitamina D.
El tiempo y la frecuencia de la evaluación de la salud ósea en MMA y PA deben estar guiados por el riesgo de cada paciente. Si las mediciones de densidad ósea (absorciometría de rayos X de energía dual [DEXA]) se aplican en niños y adolescentes en crecimiento, deben combinarse con la evaluación de la edad ósea (y el estado puberal) para una interpretación adecuada de los resultados. La osteoporosis solo puede diagnosticarse en presencia de antecedentes de fracturas clínicamente significativas, que solo se han observado escasamente en MMA y PA. En pacientes con insuficiencia renal, el diagnóstico de osteoporosis solo debe realizarse en ausencia de osteodistrofia renal.
Recomendación # 18. Sugerimos la evaluación de la salud ósea, considerando el riesgo de que los pacientes con MMA y PA tengan problemas de salud ósea.
Resultado: salud ósea.
Calidad de la evidencia: baja.
Fuerza de la recomendación: débil.
Crecimiento
Se observan malos resultados de crecimiento (peso, crecimiento lineal y perímetro cefálico) en pacientes con MMA y PA con una mayor prevalencia en MMA. Se observan pesos al nacer más bajos en comparación con la población de referencia en recién nacidos con MMA, pero no en PA.
El fallo de medro es más pronunciado en los subtipos mut0 y cblB que en los subtipos cblA y mut−y no se describen diferencias entre los pacientes de inicio temprano y tardío. El crecimiento lineal parece más afectado que el aumento de peso, lo que puede resultar en sobrepeso y obesidad en MMA y PA. Se describe un alto porcentaje de masa grasa en MMA, particularmente en mut0 y cblB, y pacientes con PA.
Recomendación # 19. Sugerimos un seguimiento regular de las mediciones antropométricas en pacientes con MMA y PA, ya que los resultados del crecimiento pueden ser deficientes.
Resultado: crecimiento normal.
Calidad de la evidencia: moderada.
Fuerza de la recomendación: débil.
Pancreatitis
Recomendación # 20: Recomendamos encarecidamente la evaluación inmediata de la pancreatitis en pacientes con MMA y PA si se sospecha clínicamente, ya que tanto la pancreatitis aguda como la crónica son complicaciones conocidas.
Resultado: pancreatitis.
Calidad de la evidencia: moderada.
Fuerza de recomendación: muy fuerte.
Calidad de vida relacionada con la salud
Recomendación # 21: Recomendamos considerar la calidad de vida relacionada con la salud como un parámetro de resultado relevante en MMA y PA.
Resultado: calidad de vida relacionada con la salud.
Calidad de la evidencia: moderada.
Fuerza de la recomendación: fuerte.
Monitorización
Se recomienda un esquema de monitorización (Tabla 5) que puede guiar el manejo clínico, pero debe adaptarse a las necesidades individuales de los pacientes. Además de los elementos representados en la tabla, recomendamos el contacto regular con un dietista metabólico. Se debe realizar un examen clínico completo en cada visita del paciente, centrado en el sistema cardiovascular y los aspectos neurológicos, pero que también incluya una evaluación de la piel, las uñas y el cabello como parte de la evaluación nutricional del paciente.
Observaciones finales
Esta actualización de las pautas de MMA y PA proporciona un resumen de la evidencia clínicamente relevante evaluada a partir de las publicaciones sobre estos trastornos. Con base en la evidencia actual, un panel diverso de profesionales de la salud experto en enfermedades metabólicas formuló 21 recomendaciones. Sigue habiendo importantes lagunas de conocimiento con respecto al manejo óptimo de los pacientes con MMA y PA.
| Tabla 5.- Monitorización | |
| Evaluación | Frecuencia |
| Seguimiento metabólico | |
| Plasma: amonio, equilibrio ácido-base, lactato; orina: cetonas | Cada visita clínica |
| Aminoácidos plasmáticos cuantitativos (3-4 h de ayuno antes de la recolección de la muestra) | 3-6 mensuales |
| Ácido metilmalónico en plasma (y orina si está disponible) | 3-6 mensuales |
| Perfil de acilcarnitinas en sangre seca o plasma (propionilcarnitina y carnitina libre) | 3-6 mensuales |
| Dieta y estado nutricional | |
| Historial dietético | Cada visita clínica |
| Crecimiento (peso, longitud o altura, perímetro cefálico) | Cada visita clínica |
| Examen clínico completo | Cada visita clínica |
| Albúmina, proteína total, transferrina | Cada 6 meses |
| Salud ósea (Ca, P, ALP, Mg, PTH, 25-OH vitamina D en sangre; Ca, P en orina) | Cada 12 meses |
| Hemograma completo, hierro, ácido fólico, vitamina B12 | Cada 12 meses |
| Complicaciones a largo plazo | |
| Examen neurológico con evaluación de los hitos del desarrollo | Cada visita clínica |
| Función renal (presión arterial, creatinina sérica, electrolitos, cistatina C, ácido úrico; pérdida de electrolitos y proteínas en la orina; TFG) | Cada 6 meses |
| Función del páncreas (lipasa, amilasa pancreática) | Cada 6 meses |
| Evaluación cardíaca (ECG) | Cada 12 meses |
| Evaluación formal del desarrollo/cognitiva | Según indicación clínica |
| EEG, resonancia magnética cerebral | Según indicación clínica |
| Evaluación oftalmológica | Cada 12 meses |
| Prueba de audición formal | Según indicación clínica |
| Abreviaturas: ALP: fosfatasa alcalina; Ca: calcio; ECG: electrocardiograma; EEG: electroencefalograma; TFG: tasa de filtración glomerular; Mg, magnesio; P: fosfato; PTH, hormona paratiroidea. | |
Más información en Guía Metabólica
- 9180 lecturas