Defectos del metabolismo de los aminoácidos ramificados (I): enfermedad de jarabe de arce

La ciudad de Rotterdam acogió en septiembre de 2019 el simposio anual SSIEM, que reúne a expertos y profesionales de todo el mundo relacionados con los errores congénitos del metabolismo. En esta reunión, la Dra. Àngels García-Carzola, jefa de la Unidad de Enfermedades Metabólicas del Hospital Sant Joan de Déu Barcelona, impartió la conferencia sobre los defectos del metabolismo de los aminoácidos ramificados.
A continuación, ofrecemos la primera parte del resumen de dicha conferencia, dedicada a la enfermedad de jarabe de arce, concretamente a los estudios recientes sobre su tratamiento y evolución de los pacientes. La segunda parte de esta conferencia lleva por titulo Defectos del metabolismo de los aminoácidos ramificados (II): otros defectos metabólicos comunes a los 3 AAR menos frecuentes.
Enfermedad de jarabe de arce, estudios recientes sobre tratamiento y evolución de los pacientes
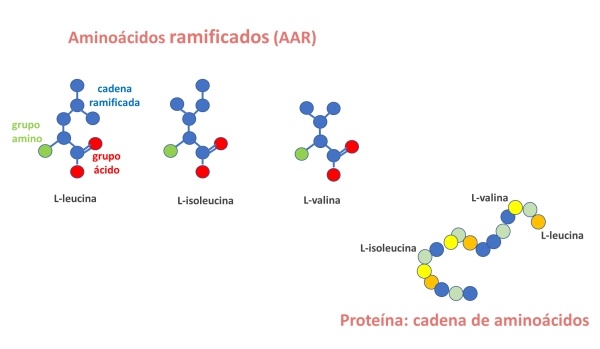
¿Qué son los aminoácidos ramificados?
Los aminoácidos ramificados (AAR) son moléculas que contienen un grupo amino, un ácido carboxílico y una cadena lateral ramificada. Los AAR proteinógenos (que forman parte de las proteínas) son leucina, isoleucina y valina. Son aminoácidos esenciales, es decir, que no se pueden sintetizar en nuestro organismo y deben ingerirse con la dieta.
¿Qué función tienen?
Los AAR son necesarios para la síntesis de proteínas y son precursores (sirven para formarlos) de otros aminoácidos: ácido glutámico, glutamina y alanina. Están también implicados en la síntesis de lípidos (grasas) y en los procesos de autofagia y homeostasis metabólica.
La leucina es un activador de la proteína mTOR1, que es un gran regulador de la proliferación y el crecimiento celular. Además, la leucina y la isoleucina son aminoácidos cetogénicos, es decir, que son precursores de cuerpos cetónicos a nivel hepático en condiciones de hipoglucemia.
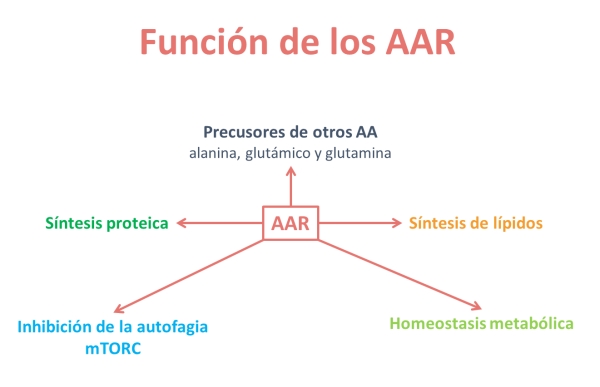
Asimismo, en el sistema nervioso central, los AAR intervienen en la síntesis de neurotransmisores (glutámico, GABA, glutamina), la síntesis de proteínas cerebrales, la regulación de la ingesta proteica y están implicados en diversas enfermedades.
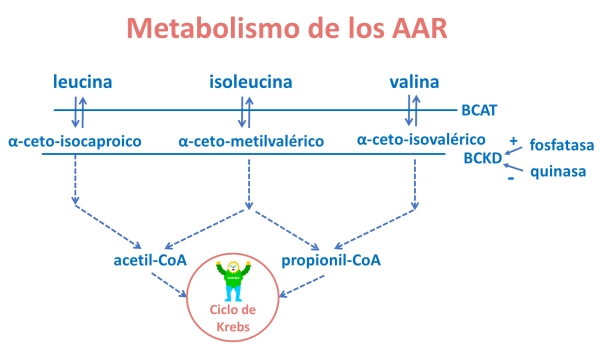
¿Cómo se metabolizan los AAR?
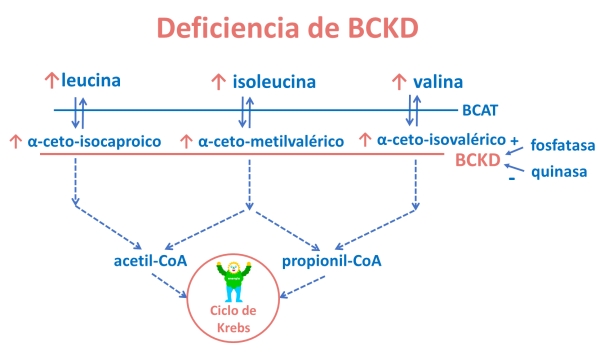
Los dos primeros pasos de la degradación de los AAR son comunes a los tres AAR, mientras que a partir del tercer paso cada uno de ellos se degrada mediante una ruta diferente.
El primer paso de transaminación (eliminación del grupo amino) se realiza en tejidos periféricos (fuera del hígado) mediante la enzima aminotransferasa de los AAR (BCAT), que los convierte en cetoácidos. Estos son transferidos al hígado, donde serán descarboxilados mediante un complejo enzimático: la deshidrogenasa de los cetoácidos ramificados (BCKD), que está regulada a su vez por dos enzimas, una fosfatasa que la activa y una quinasa que la inactiva.
A partir de este paso, los tres cetoácidos siguen rutas diferentes que conducen finalmente a la formación de compuestos que convergen en el ciclo de Krebs, destinado a la síntesis de energía.
Defectos genéticos de los AAR
Cuando existen mutaciones (cambios genéticos hereditarios) en los genes que codifican a las proteínas enzimáticas implicadas en la degradación de los AAR, se interfieren las rutas catabólicas (de degradación) de los mismos, lo que causa una alteración metabólica que puede tener consecuencias clínicas más o menos graves.
¿Cuáles son los principales defectos metabólicos que afectan a los tres AAR?
El más importante por su frecuencia y su gravedad es la Enfermedad de orina con olor a jarabe de arce (MSUD, del inglés: Maple Syrup Urine Disease). Está causada por la deficiencia de la deshidrogenasa de los cetoácidos ramificados (BCKD), común a las tres rutas de degradación de los AAR. Esto da lugar a la gran acumulación de los aminoácidos y cetoácidos ramificados en sangre, orina y tejidos.
Debido a la toxicidad de estos compuestos acumulados, se producen unas manifestaciones clínicas de gravedad variable en las distintas formas de presentación de la enfermedad.
La forma clásica se presenta en el período neonatal con un retraso en el desarrollo, fallo de medro, dificultades en la alimentación, olor a jarabe de arce en el cerumen y orina (de ahí el nombre de la enfermedad) y puede dar lugar a complicaciones neurológicas irreversibles (movimientos estereotípicos, descompensación metabólica e incluso la muerte si no se trata urgentemente).
El diagnóstico se había basado tradicionalmente en la sospecha clínica debida a la descompensación metabólica, seguida del estudio de las elevadas concentraciones de aminoácidos (leucina, isoleucina, valina y aloisoleucina) en sangre y orina, cetoácidos en orina y la confirmación posterior del defecto enzimático y el estudio genético. El cribado neonatal, que se realiza actualmente en la mayoría de países, consigue un diagnóstico más precoz y un tratamiento más prematuro.
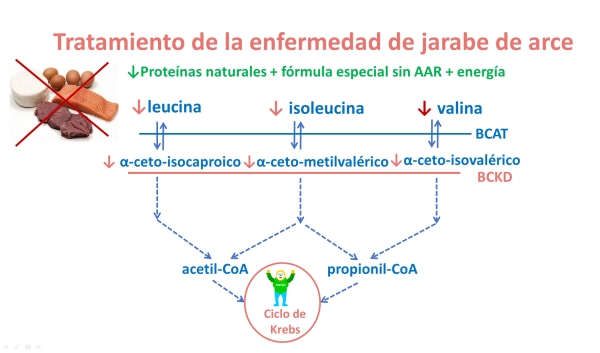
El tratamiento consiste en la restricción dietética de los AAR, suplementando con una fórmula especial sin ellos, acompañada de suplementos energéticos y un estrecho control metabólico.
El pronóstico es generalmente bueno si el tratamiento se instaura con la mayor brevedad posible. Por ello los pacientes diagnosticados mediante el cribado metabólico neonatal muestran mejor evolución que los tratados más tardíamente.
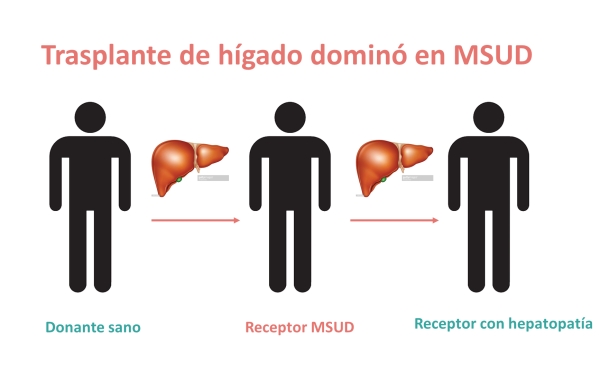
Trasplante de hígado como tratamiento en pacientes con MSUD
El trasplante de hígado es una posibilidad de tratamiento alternativo a tener en cuenta en pacientes con MSUD. Se han descrito algunas largas series de pacientes con trasplante dominó (consiste en utilizar el hígado del receptor para otros pacientes con enfermedad hepática) realizado con éxito, no observándose elevación de metabolitos tóxicos en el receptor del hígado (37 pacientes (Mazariegos y col, 2012, Pittsburgh Medical Center, USA), 15 pacientes (Herden y col, 2019, University Medical Center Hamburg-Eppendorf, Hamburg, Germany), entre otros.
Estudios recientes sobre la evolución de pacientes con MSUD
Recientemente se han publicado diversos estudios que revisan la evolución de extensos grupos de pacientes con MSUD mediante estudios retrospectivos.
En un estudio multicéntrico español (Couce y col, 2015, Hospital Clínico Universitario de Santiago de Compostela) se revisa la evolución de 14 pacientes con MSUD, 8 diagnosticados mediante cribado neonatal, comparándola con la de 6 pacientes con diagnostico tardío. Los primeros permanecieron asintomáticos, excepto dos que mostraron un trastorno de déficit de atención e hiperactividad.
Los pacientes de diagnóstico tardío presentaban encefalopatía aguda al diagnóstico y una media de hospitalizaciones de 5,3). Solo dos de ellos tenían un índice de desarrollo psicomotor en el límite bajo (80 y 83).
Se concluye que el cribado neonatal mejora el pronóstico, pero el diagnóstico temprano y el tratamiento agresivo, con una monitorización estrecha del nivel de leucina, mejora la evolución incluso en los pacientes no diagnosticados mediante el cribado neonatal.
En un estudio (Abi-Wardé MT y col, 2017,) de 35 pacientes con la forma clásica neonatal de MSUD se investiga la relación entre parámetros metabólicos y clínicos y la evolución psicosocial. Se observó que las descompensaciones metabólicas fueron más frecuentes durante el primer año de vida debido a infecciones, y a partir de los 15 años debido a transgresiones dietéticas propias de la edad.
Los niveles de leucina se elevaron significativamente en la edad adulta: un 61 % de los adultos eran independientes y alcanzaron una integración social y profesional adecuada; un 56 % requirieron atención psicológica o psiquiátrica ocasional (trastornos emocionales, de humor y de ansiedad).
Se concluyó que la elevación de los niveles de leucina en la edad adulta causaba una mayor toxicidad crónica. La atención psicológica se asociaba a la edad y al número de descompensaciones. Se dedujo que la implicación de los padres era crucial en el tratamiento de los pacientes con MSUD.
En otro estudio multicéntrico retrospectivo (Bouchereau J y col, 2017, Hôpital Necker Enfants Malades, Paris) del perfil neurocognitivo en 21 pacientes con la forma clásica de MSUD en edad escolar (edad media: 8,7 años), se constató que el coeficiente intelectual medio estaba dentro del rango normal (95.1 ± 12.6). El perfil neurocognitivo de algunos pacientes estudiados demostraba mejor habilidad verbal que ejecutiva, que no se relacionaba con el buen control metabólico a largo plazo.
- 7402 lecturas



